题目内容
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、标准状况下,将22.4L氯化氢溶于足量水中,溶液中含有的HCl分子数为NA |
| B、常温常压下,16g14CH4所含中子数目为8NA |
| C、常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA |
| D、标准状况下,22.4L空气含有NA个单质分子 |
考点:阿伏加德罗常数
专题:
分析:A、HCl溶于水后得盐酸,盐酸溶液中无HCl分子;
B、根据n=
并结合14CH4所含中子数来分析;
C、根据Na2O2与H2O的反应为歧化反应来分析;
D、空气是多种气体单质和气体化合物的混合物.
B、根据n=
| m |
| M |
C、根据Na2O2与H2O的反应为歧化反应来分析;
D、空气是多种气体单质和气体化合物的混合物.
解答:
解:A、HCl溶于水共价键被破坏,故盐酸溶液中无HCl分子,故A错误;
B、根据n=
可知物质的量n=
=
mol,而1mol14CH4中所含的中子数为8mol,故
mol14CH4中所含的中子数为
mol,故B错误;
C、Na2O2与H2O的反应为歧化反应:2Na2O2+2H2O=4NaOH+O2↑此反应生成1molO2转移2mol电子,故生成0.2molO2,转移电子的数目为0.4NA,故C正确;
D、空气是多种气体单质和气体化合物的混合物,故1mol空气中的分子数为NA个,单质分子数小于NA个,故D错误.
故选C.
B、根据n=
| m |
| M |
| 16g |
| 18g/mol |
| 8 |
| 9 |
| 8 |
| 9 |
| 64 |
| 9 |
C、Na2O2与H2O的反应为歧化反应:2Na2O2+2H2O=4NaOH+O2↑此反应生成1molO2转移2mol电子,故生成0.2molO2,转移电子的数目为0.4NA,故C正确;
D、空气是多种气体单质和气体化合物的混合物,故1mol空气中的分子数为NA个,单质分子数小于NA个,故D错误.
故选C.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
| A、将少量SO2气体通入NaClO溶液中 SO2+2ClO-+H2O=SO32-+2HClO |
| B、向KHSO4溶液中加入Ba(OH)2溶液至所得溶液的pH=7 Ba2++OH-+H++SO42-=BaSO4↓+2H2O |
| C、向Ca(H2PO4)2溶液中滴入过量的NaOH溶液 3Ca2++6H2PO4-+12OH-=Ca3(PO4)2↓+4PO43-+12H2O |
| D、112mL(标况)Cl2通入10mL1mol/L的FeBr2溶液中 2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2 |
下列说法正确的是( )
| A、麦芽糖与蔗糖的水解产物均为葡萄糖,且均为二糖 |
| B、加热能杀死流感病毒是因为病毒的蛋白质受热变性 |
| C、赤潮、白色污染、绿色食品中的“赤”“白”“绿”均指相关物质的颜色 |
| D、乙烯、氯乙烯、苯乙烯都是不饱和烃,均可用于合成有机高分子材料 |
在甲、乙两个体积不同的密闭容器中,分别充入质量相同的CO、CO2气体时,两容器的温度和压强均相同,则下列说法正确的是( )
| A、充入的CO分子数比CO2分子数少 |
| B、甲容器的体积比乙容器的体积小 |
| C、CO的摩尔体积比CO2的摩尔体积小 |
| D、甲中CO的密度比乙中CO2的密度小 |
甲苯 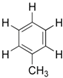 苯环上的一个氢原子被含3个碳原子的烷基所取代,可能得到的一元取代物有( )
苯环上的一个氢原子被含3个碳原子的烷基所取代,可能得到的一元取代物有( )
 苯环上的一个氢原子被含3个碳原子的烷基所取代,可能得到的一元取代物有( )
苯环上的一个氢原子被含3个碳原子的烷基所取代,可能得到的一元取代物有( )| A、3种 | B、4种 | C、5种 | D、6种 |
热还原法冶炼金属的反应一定是( )
| A、置换反应 | B、分解反应 |
| C、复分解反应 | D、氧化还原反应 |
下列反应的离子方程式正确的是( )
| A、Fe与FeCl3溶液反应:Fe+Fe3+=2Fe2+ |
| B、往AlCl3溶液中滴入氨水:Al3++3OH-=Al(OH)3↓ |
| C、铁与稀盐酸反应:Fe+2H+=Fe2++H2↑ |
| D、氯化钡与硫酸反应:Ba2++SO42-=BaSO4↓ |
 实验室用如图装置制取乙酸乙酯.
实验室用如图装置制取乙酸乙酯.