题目内容
下面有关Na2CO3 与NaHCO3的性质比较中错误的是( )
| A、相同质量时消耗的HCl:Na2CO3>NaHCO3 |
| B、相同物质的量时消耗的HCl:Na2CO3>NaHCO3 |
| C、与同浓度的硫酸反应放出气泡的速率:NaHCO3<Na2CO3 |
| D、热稳定性:NaHCO3<Na2CO3 |
考点:钠的重要化合物
专题:元素及其化合物
分析:NaHCO3不稳定,加热易分解生成碳酸钠;NaHCO3和Na2CO3与酸发生反应时,分别发生Na2CO3+2HCl═2NaCl+H2O+CO2↑,NaHCO3+HCl═NaCl+H2O+CO2↑,结合反应的方程式判断.
解答:
解:A.NaHCO3和Na2CO3与酸发生反应时,分别发生Na2CO3+2HCl═2NaCl+H2O+CO2↑,NaHCO3+HCl═NaCl+H2O+CO2↑;
A.依据方程式可知1molNa2CO3消耗2molHCl,168g碳酸氢钠消耗2molHCl,所以相同质量时消耗的HCl:Na2CO3>NaHCO3,故A正确;
B.依据方程式可知1molNa2CO3消耗1molHCl,168g碳酸氢钠消耗2molHCl,相同物质的量时消耗的HCl:Na2CO3>NaHCO3,故A正确;
C.碳酸氢根离子结合氢离子会生成二氧化碳,反应速率快,碳酸根离子结合氢离子生成碳酸氢根离子,再结合氢离子生成二氧化碳,反应速率慢,故C错误;
D.NaHCO3不稳定,加热易分解生成碳酸钠,所以碳酸钠稳定性强于碳酸氢钠,故D正确;
故选:C.
A.依据方程式可知1molNa2CO3消耗2molHCl,168g碳酸氢钠消耗2molHCl,所以相同质量时消耗的HCl:Na2CO3>NaHCO3,故A正确;
B.依据方程式可知1molNa2CO3消耗1molHCl,168g碳酸氢钠消耗2molHCl,相同物质的量时消耗的HCl:Na2CO3>NaHCO3,故A正确;
C.碳酸氢根离子结合氢离子会生成二氧化碳,反应速率快,碳酸根离子结合氢离子生成碳酸氢根离子,再结合氢离子生成二氧化碳,反应速率慢,故C错误;
D.NaHCO3不稳定,加热易分解生成碳酸钠,所以碳酸钠稳定性强于碳酸氢钠,故D正确;
故选:C.
点评:本题考查碳酸钠和碳酸氢钠的性质比较,是基础性试题的考查,解题关键是熟练掌握二者的化学性质,题目难度不大.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
下列各组离子在指定条件下能大量共存的是( )
| A、无色溶液中:Cu2+、Na+、Cl-、NO3- |
| B、强酸性溶液中:Na+、K+、OH-、Cl- |
| C、含Fe3+的溶液中:K+、Ca2+、NO3-、OH- |
| D、澄清透明溶液中:Fe2+、Na+、SO42-、Cl- |
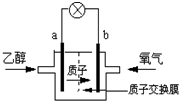 一种新型乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意图如图.下面对这种电池的说法正确的是( )
一种新型乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意图如图.下面对这种电池的说法正确的是( )| A、b极为电池的负极 |
| B、设每个电子所带电量为q库仑,则1mol乙醇被氧化产生12NAq库仑的电量 |
| C、电池工作时电流由a极沿导线经灯泡再到b极 |
| D、电池正极的电极反应为:O2+4e-+2H2O=4OH- |
下列说法正确的是( )
| A、分子晶体中一定不含离子键,但一定存在共价键 |
| B、熔融状态下能导电的化合物一定含离子键;金属与非金属元素形成的化合物一定是离子化合物 |
| C、NCl3分子中所有的原子均为8电子稳定结构 |
| D、NaHSO4晶体中阴、阳离子的个数比是1:2,且熔化时破坏的是离子键和共价键 |
把Ba(OH)2溶液逐滴滴入明矾[KAl(SO4)2?12H2O]溶液中,可能发生的离子方程式是( )
| A、2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
| B、A13++2SO42-+2Ba2++3OH-=A1(0H)3↓+2BaSO4↓ |
| C、2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O |
| D、Ba2++3OH-+Al3++SO42-=BaSO4↓+A1(0H)3↓ |
氮化钠和氢化钠都是离子化合物,与水反应的化学方程式(未配平)如下:
Na3N+H2O→NaOH+NH3
NaH+H2O→NaOH+H2
有关它们的叙述正确的是( )
Na3N+H2O→NaOH+NH3
NaH+H2O→NaOH+H2
有关它们的叙述正确的是( )
| A、离子半径:N3->Na+>H+ |
| B、与水反应都是氧化还原反应 |
| C、与盐酸反应都只生成一种盐 |
| D、两种化合物中的阴阳离子均具有相同的电子层结构 |
下列有关说法不正确的是( )
| A、实验室制取氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 |
| B、为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 |
| C、已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3kJ?mol-1则水电离的热化学方程式为:H2O(l)?H+(aq)+OH-(aq)△H=+57.3 kJ?mol-1 |
| D、生铁发生吸氧腐蚀和析氢腐蚀的负极反应均为:Fe-2e-=Fe2+ |