题目内容
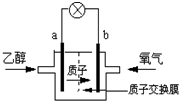 一种新型乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意图如图.下面对这种电池的说法正确的是( )
一种新型乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意图如图.下面对这种电池的说法正确的是( )| A、b极为电池的负极 |
| B、设每个电子所带电量为q库仑,则1mol乙醇被氧化产生12NAq库仑的电量 |
| C、电池工作时电流由a极沿导线经灯泡再到b极 |
| D、电池正极的电极反应为:O2+4e-+2H2O=4OH- |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:由质子的定向移动可知a为负极,b为正极,负极发生氧化反应,乙醇被氧化生成CO2和,电极反应式为C2H5OH+3H2O-12e-=2CO2+12H+,正极氧气得到电子被还原,电极反应式为4H++O2+4e-=2H2O,结合电极反应解答该题.
解答:
解:A.根据质子移动方向知,a是负极,b是正极,故A错误;
B.1mol乙醇被氧化失去12mol电子,则1mol乙醇被氧化产生12NAq厍仑的电量,故B正确;
C.a是负极,b是正极,电流从正极沿导线流向负极,即b极到a极,故B错误;
D.正极上氧气得电子和氢离子反应生成水,电极反应式为4H++O2+4e-=2H2O,故D错误;
故选B.
B.1mol乙醇被氧化失去12mol电子,则1mol乙醇被氧化产生12NAq厍仑的电量,故B正确;
C.a是负极,b是正极,电流从正极沿导线流向负极,即b极到a极,故B错误;
D.正极上氧气得电子和氢离子反应生成水,电极反应式为4H++O2+4e-=2H2O,故D错误;
故选B.
点评:本题考查了原电池原理,根据质子移动方向确定正负极,再结合正负极上得失电子书写电极反应式,难点是电极反应式的书写,也为易错点.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
下列说法正确的是( )
| A、自来水厂常用液氯给自来水消毒,主要是因为Cl2具有强氧化性 |
| B、限制大排量汽车,也是防止酸雨的重要途径 |
| C、镀金的钢铁器件既能增加美观,又可以在即使镀层局部破损后防止器件的损耗 |
| D、当今网络的飞速发展,得益于光纤良好的导电性 |
nmol H2O与mmolCaCO3中,氧元素的质量比是( )
| A、n:m | B、1:3 |
| C、n:3m | D、50n:27m |
用铁片与稀H2SO4反应制取H2,下列措施不能使H2的生成速率增大的是( )
| A、加热 |
| B、不用铁片,改用铁粉 |
| C、增加H+的浓度 |
| D、不用稀H2SO4,改用98%的浓H2SO4 |
下列说法中不正确的是( )
| A、患口腔溃疡时可服用维生素B2,它存在于牛奶和蛋黄等食物中 |
| B、多吃胡萝卜,可预防夜盲症,因其中含有丰富的维生素A |
| C、维生素C具有止血功能,所以被称为抗坏血酸 |
| D、维生素K是凝血酶元的主要成分,它是止血的功臣 |
下列有关物质性质的应用错误的是( )
| A、H2O2溶液有氧化性,可用于杀菌消毒 |
| B、氯化镁是一种电解质,可用于电解法制镁 |
| C、液氨汽化时要吸收大量的热,可用作制冷剂 |
| D、Na2SO4能使蛋白质发生变性,可用于提纯蛋白质 |
设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A、已知t℃时,MgCO3的Ksp=4×10-6,则MgCO3饱和溶液中含Mg2+数目为2×10-3 NA |
| B、一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数一定为0.1NA |
| C、CO2通过Na2O2使其增重bg时,反应中转移的电子数为bNA/44 |
| D、1mol带有乙基支链的烷烃,分子中所含碳原子数最少为5NA |
下面有关Na2CO3 与NaHCO3的性质比较中错误的是( )
| A、相同质量时消耗的HCl:Na2CO3>NaHCO3 |
| B、相同物质的量时消耗的HCl:Na2CO3>NaHCO3 |
| C、与同浓度的硫酸反应放出气泡的速率:NaHCO3<Na2CO3 |
| D、热稳定性:NaHCO3<Na2CO3 |
