题目内容
6.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )| A. | 0.5molCl2通入足量水中充分反应.转移的电子数等于0.5NA | |
| B. | 46gNO2和N2O4混合气体中含有原子总数为3NA | |
| C. | 标准状况下,22.4LSO3中含有的分子数为NA. | |
| D. | 1L0.1mol/L的NaHSO3溶液中,HSO32-、SO32-的离子数之和为0.1NA |
分析 A.氯气与水反应为可逆反应;
B.NO2和N2O4的最简式均为NO2;
C.气体摩尔体积使用对象为气体;
D.亚硫酸氢根离子部分水解生成亚硫酸和氢氧根离子,部分电离产生亚硫酸根离子和氢离子,结合物料守恒解答.
解答 解:A.氯气与水反应为可逆反应,可逆反应不能进行到底,所以0.5molCl2通入足量水中充分反应.转移的电子数小于0.5NA,故A错误;
B.NO2和N2O4的最简式均为NO2,46g NO2和N2O4混合气体中含有NO2的物质的量n=$\frac{46g}{46g/mol}$=1mol,故含有3mol原子,即3NA个,故B正确;
C.标况下,三氧化硫不是气体,不能使用气体摩尔体积,故C错误;
D.1L0.1mol/L的NaHSO3溶液中,依据物料守恒得:H2SO3、HSO32-、SO32-的离子数之和为0.1NA,则HSO32-、SO32-的离子数之和小于0.1NA,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意气体摩尔体积使用条件和对象,题目难度不大.侧重于基础知识的考查.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.如图是实验室制取无水氯化镁的装置图,下列有关表述不正确的是( )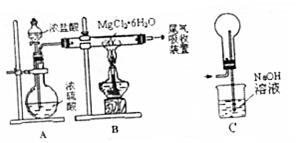

| A. | 装置A制取HCl利用了浓硫酸的吸水性 | |
| B. | 如果直接加热MgCl2•6H2O不能得到MgCl2,将得到Mg(OH)Cl或MgO | |
| C. | 用装置C做为尾气吸收装置,直接与B相连 | |
| D. | 这套装置在设计时未考虑反应结束后滞留在装置中的有害气体的吸收 |
14.下列叙述正确的是( )
| A. | 直径介于1nm~100nm之间的微粒称为胶体 | |
| B. | 电泳现象可证明胶体带电 | |
| C. | 渗析法可用于含有氯化钠的淀粉溶液的提纯 | |
| D. | 用含1molFeCl3的溶液可制得6.02×1023个Fe(OH)3胶体粒子 |
1.下列各组离子一定能大量共存的是( )
| A. | 在中性溶液中:Fe3+、NO3-、SO42-、Al3+ | |
| B. | 0.1 mol•L-1 NH4HCO3溶液中:K+、Na+、SO42-、Al3+ | |
| C. | Na2S溶液中:SO42-、K+、Cl-、OH- | |
| D. | 在溶质为KNO3和NaHSO4的溶液中:Fe2+、Na+、Al3+、Cl- |
15.已知 X、Y 为第三周期非金属元素(稀有气体除外),且电负性 X>Y,下列说法错误的 是( )
| A. | X 与 Y 形成化合物时,X 可能显负价,也可能显正价 | |
| B. | 第一电离能 X 可能小于 Y | |
| C. | X 的最高价含氧酸的酸性强于 Y 的最高价含氧酸的酸性 | |
| D. | 原子序数 X 一定大于 Y |
16.下列说法不正确的是( )
| A. | 将0.4mol/LNH4Cl溶液和0.2molNaOH溶液等体积混合后,溶液中粒子的物质的量浓度大小关系为:c(NH4+)>c(Na+)>c(NH3•H2O)>c(OH-)>c(H+) | |
| B. | SiO2(s)+2C(s)═Si(s)+2CO(g)在常温下不能自发进行,则该反应的△H>0 | |
| C. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:2c(Na+)═c(CH3COO-)+c(CH3COOH) | |
| D. | 在相同条件下,NaHCO3溶液和NaHSO3溶液中,水的电离平衡均被促进 |