题目内容
19.写出电子式:KCl ;Na2O2
;Na2O2 ; CO2
; CO2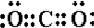 .
.
分析 首先判断化合物是离子化合物还是共价化合物;依据电子式的书写写出,即把原子的最外层电子表示出来;
若是离子化合物,其电子式由阴、阳离子的电子式组合而成,相同的离子不能合并;
若是共价化合物,其电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况.
解答 解:KCl存在钾离子和氯离子,钾离子为简单阳离子,氯离子最外层为8电子,氯化钾的电子式为 ;
;
Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为 ;
;
CO2是共价化合物,碳原子有四个电子分别和氧原子形成两对共用电子对,电子式为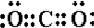 ;
;
故答案为: ;
; ;
;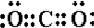 .
.
点评 本题考查了电子式的书写方法,难度不大,一般共价化合物中各元素的化合价的绝对值就是该元素原子形成的共用电子对数;原子团的电子式不仅要标出最外层电子数,而且要用“[]”括起来,在右上角标明离子所带的电荷,并要表示出两原子之间的共用电子对情况.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
7.已知各破坏1mol N≡N键、H-H键和N-H键分别需要吸收的能量为946kJ、436kJ、391kJ.计算1mol N2(g)和3mol H2(g)完全转化为NH3(g)的能量变化为( )
| A. | 吸收92KJ | B. | 放出92kJ | C. | 吸收184kJ | D. | 放出184KJ |
14.“司乐平”是治疗高血压的一种临床药物,其有效成分M的结构简式如下图所示.
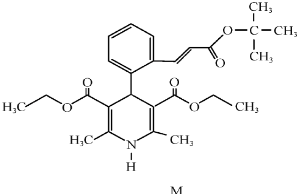
下列关于M的说法正确的是( )

下列关于M的说法正确的是( )
| A. | 属于芳香族化合物 | B. | 遇FeCl3溶液显紫色 | ||
| C. | 不能使酸性高锰酸钾溶液褪色 | D. | 1molM完全水解生成2mol醇 |
8.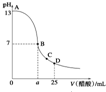 25℃时,在25mL 0.1mol•L-1的NaOH溶液中,逐滴加入0.2mol•L -1的CH3COOH溶液,溶液的pH与醋酸体积关系如图所示,下列分析不正确的是( )
25℃时,在25mL 0.1mol•L-1的NaOH溶液中,逐滴加入0.2mol•L -1的CH3COOH溶液,溶液的pH与醋酸体积关系如图所示,下列分析不正确的是( )
 25℃时,在25mL 0.1mol•L-1的NaOH溶液中,逐滴加入0.2mol•L -1的CH3COOH溶液,溶液的pH与醋酸体积关系如图所示,下列分析不正确的是( )
25℃时,在25mL 0.1mol•L-1的NaOH溶液中,逐滴加入0.2mol•L -1的CH3COOH溶液,溶液的pH与醋酸体积关系如图所示,下列分析不正确的是( )| A. | B点的横坐标a>12.5 | |
| B. | C点时溶液中有:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | D点时溶液中有:c(CH3COO-)+c(CH3COOH)=2c(Na+) | |
| D. | 曲线上A、B间的任意一点,溶液中都有:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
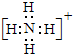
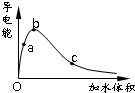 一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示:
一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示: