题目内容
10.初中实验用碳还原氧化铜来制备金属铜,要求温度较高,普通酒精灯很难达到该温度.某实验小组用无水硫酸铜代替氧化铜,只需用普通酒精灯加热反应,能达到相同的实验目的.将生成的混合气体通入以下装置进行检验,试回答下列问题: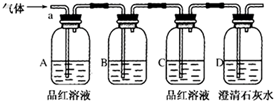
(1)A中的品红溶液褪色,证明有SO2气体;C中品红溶液无明显现象,D中的澄清石灰水
变浑浊,证明有CO2气体;
(2)B中可加入ad,以除去混合气体中的某种气体;
a、酸性高锰酸钾溶液 b、饱和碳酸氢钠溶液
c、饱和氯化钠溶液 d、溴水
(3)依据上述实验现象,请写出碳还原硫酸铜的化学方程式CuSO4+C$\frac{\underline{\;加热\;}}{\;}$Cu+SO2↑+CO2↑.
分析 (1)SO2具有漂白性,能使澄清石灰水变浑浊;
(2)检验二氧化碳之前要先把二氧化硫除去,二氧化硫具有还原性;
(3)碳还原硫酸铜生成Cu、二氧化硫和二氧化碳.
解答 解:(1)SO2具有漂白性,所以把二氧化硫通过品红溶液,品红溶液会褪色,则A中的品红溶液褪色,证明有SO2,能使澄清石灰水变浑浊;把混合气体中的SO2除去以后,再通过澄清石灰水,石灰水变浑浊,说明有CO2;
故答案为:SO2;CO2;
(2)检验二氧化碳之前要先把二氧化硫除去,二氧化硫具有还原性,可以用具有强氧化性的溶液来吸收,所以可选用高锰酸钾溶液或溴水;
故答案为:ad;
(3)由实验可知,生成的气体为SO2和CO2,所以碳还原硫酸铜生成Cu、二氧化硫和二氧化碳,其反应方程式为:CuSO4+C$\frac{\underline{\;加热\;}}{\;}$Cu+SO2↑+CO2↑;
故答案为:CuSO4+C$\frac{\underline{\;加热\;}}{\;}$Cu+SO2↑+CO2↑.
点评 本题考查了物质的检验方法、探究物质的组成等,题目难度中等,侧重于考查学生的分析能力和实验探究能力,注意把握二氧化硫的还原性和漂白性.

练习册系列答案
相关题目
19.下列实验设计不正确的是( )
| A. | 检验溶液中I-:取样→滴加氯水→再滴加淀粉溶液,溶液变蓝 | |
| B. | 检验溶液中的Fe2+:取样$\stackrel{KSCN溶液}{→}$无明显现象$\stackrel{KMnO_{4}}{→}$红色溶液 | |
| C. | 证明氧化性Fe3+>Cu2+:向FeCl3、CuCl2混合液中加入少量铁粉,无红色固体产生 | |
| D. | 配制0.5mol•L-1的CuSO4溶液:用天平称取12.5g CuSO4•5H2O配成100mL溶液 |
5.取四张湿润的蓝色石蕊试纸放在玻璃片上,然后按顺序分别滴加69%的硝酸、98.3%的硫酸、新制氯水、浓氨水,四张试纸最后呈现的颜色是( )
| A. | 白、红、白、蓝 | B. | 白、白、白、蓝 | C. | 白、黑、白、蓝 | D. | 红、黑、红、蓝 |
2.合成药物异搏定路线中某一步骤如下:
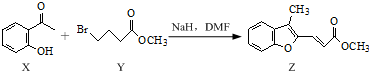
下列说法正确的是( )
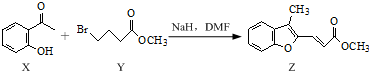
下列说法正确的是( )
| A. | 物质X在空气中不易被氧化 | |
| B. | 物质Y中只含1个手性碳原子 | |
| C. | 物质Z中所有碳原子可能在同一平面内 | |
| D. | 等物质的量的X、Y分别与NaOH反应,最多消耗NaOH的物质的量之比为1:2 |
20.有CH3OH、CH3COOH和丙三醇(C3H8O3)组成的混合液体,其中碳的质量分数39%,则氢的质量分数为( )
| A. | 6.7% | B. | 8.7% | C. | 9% | D. | 12.5% |
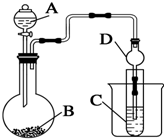 某兴趣小组设计如下实验来证明同周期元素Cl和S的非金属性强弱.
某兴趣小组设计如下实验来证明同周期元素Cl和S的非金属性强弱. ;
; ;
;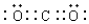 ;
; ;
; ;Na2O2
;Na2O2 ; CO2
; CO2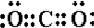 .
.