题目内容
9.原子,元素,核素,同位素等都属于重要的化学基本概念.下列八种化学符号:${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{6}^{14}$C、${\;}_{3}^{6}$Li、${\;}_{11}^{23}$Na、${\;}_{7}^{14}$N、${\;}_{3}^{7}$Li、${\;}_{12}^{24}$Mg
(1)涉及的核素共有8种;
(2)互为同位素的是36Li、37Li或11H、12H;
(3)质量数相等,但不能互称为同位素的是614C、714N;
(4)中子数相等,但质子数不相等的是1123Na;1224Mg.
分析 (1)核素是指具有一定数目质子和一定数目中子的一种原子;
(2)具有相同质子数,不同中子数同一元素的不同原子互为同位素;
(3)根据同位素的概念和原子的表示方法思考;
(4)根据质量数=质子数+中子数的关系计算.
解答 解:(1)核素是指具有一定数目的质子和一定数目的中子的一种原子,属于原子的有11H、12H、614C、36Li、1123Na、714N、37Li,1224Mg,它们都表示核素,即共有8种核素,
故答案为:8;
(2)质子数相同而中子数不同的同一元素的不同原子互称同位素,在8种微粒中,36Li、37Li质子数都是3,而中子数分别为3和4,即二者互为同位素.11H、12H质子数都是1,而中子数分别为0和1,即二者互为同位素.
故答案为:36Li、37Li;11H、12H;
(3)在8中微粒中,质量数相等的是614C、714N,它们的质子数分别为6和7而不相同,它们不能互称同位素,
故答案为:614C、714N;
(4)根据质子数等于质子数与中子数之和得,11H、12H、614C、36Li、1123Na、714N、37Li、1224Mg的中子数分别为0、1、8、3、12、7、4、12,因此中子数相等,但质子数不相等的是1123Na、1224Mg,
故答案为:1123Na;1224Mg.
点评 本题考查了核素、同位素,原子中微粒之间的关系、基本计算,只要理解了基本概念,掌握了计算关系即可解答,本题难度不大.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
20.有CH3OH、CH3COOH和丙三醇(C3H8O3)组成的混合液体,其中碳的质量分数39%,则氢的质量分数为( )
| A. | 6.7% | B. | 8.7% | C. | 9% | D. | 12.5% |
1.接触法制硫酸工艺中,其主反应在450.C并有催化剂存在下进行.
2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/moL
下列说法正确的是( )
2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/moL
下列说法正确的是( )
| A. | 增大O2的浓度可以提高反应速率和SO2的转化率 | |
| B. | 使用催化剂可以提高SO2的转化率 | |
| C. | 反应在450℃时的平衡常数小于500℃时的平衡常数 | |
| D. | 2moLSO2(g)和1moLO2(g)所含的总能量小于2moLSO3(g)所含的总能量 |
18.下图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或者化学式填空回答:
(1)在这些元素中,可以做半导体材料的是Si,化学性质最不活泼的原子结构示意图为 ;
;
(2)元素最高价氧化物对应水化物中,酸性最强的是HClO4(填酸的化学式,下同)碱性最强的是NaOH;呈现两性的是Al(OH)3;写出三者之间相互反应的化学方程式H++OH-=H2O;Al(OH)3+3H+=Al3++3H2O;Al(OH)3+OH-=AlO2-+2H2O;
(3)元素②③④⑤离子半径由大到小的顺序是O2->F->Na+>Mg2+;
(4)元素①的最高价氧化物的水化物的稀溶液与铜反应的化学方程式3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O;
(5)元素①和⑨的氢化物之间反应的化学方程式为NH3+HCl=NH4Cl;
(6)元素③和⑨的氢化物的酸性强弱顺序为HCl>HF.
| 族 周期 | IA | IIA | ⅢA | ⅣA | VA | VIA | VIIA | 0 |
| ① | ② | ③ | ||||||
| ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
 ;
;(2)元素最高价氧化物对应水化物中,酸性最强的是HClO4(填酸的化学式,下同)碱性最强的是NaOH;呈现两性的是Al(OH)3;写出三者之间相互反应的化学方程式H++OH-=H2O;Al(OH)3+3H+=Al3++3H2O;Al(OH)3+OH-=AlO2-+2H2O;
(3)元素②③④⑤离子半径由大到小的顺序是O2->F->Na+>Mg2+;
(4)元素①的最高价氧化物的水化物的稀溶液与铜反应的化学方程式3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O;
(5)元素①和⑨的氢化物之间反应的化学方程式为NH3+HCl=NH4Cl;
(6)元素③和⑨的氢化物的酸性强弱顺序为HCl>HF.
19.几种短周期元素的原子半径及主要化合价如下表:
下列叙述正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 104 | 66 |
| 主要化合价 | +2 | +3 | +6、+4、-2 | -2 |
| A. | X、Y元素的金属性X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW3 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 |
 ;Na2O2
;Na2O2 ; CO2
; CO2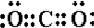 .
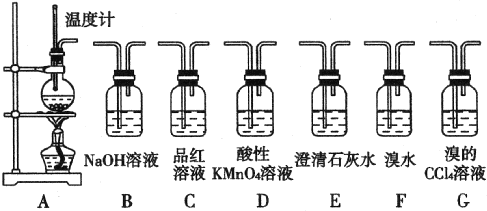
.
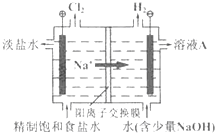 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.完成下列填空:
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.完成下列填空: