题目内容
10.用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示(电极材料为石墨).下列有关叙述不正确的是( )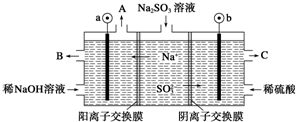
| A. | 图中a极连接电源的负极 | |
| B. | A口放出的物质是氢气,C口放出的物质是氧气 | |
| C. | b极电极反应式为:SO32--2e-+H2O═SO42-+2H+ | |
| D. | 电解过程中阴极区碱性明显增强 |
分析 依据电解质溶液中阴阳离子的移动方向判断电极,阳离子移向阴极,a为阴极,b为阳极,SO32-在阳极失去电子变成SO42-,可能伴有氢氧根离子放电生成氧气,所以C口流出的物质是H2SO4,阴极区放电离子为氢离子生成氢气,据此解答.
解答 解:A、Na+移向阴极区,SO32-移向阳极区,所以a极为阴极,应接电源负极,故A正确;
B、阴极区放电离子为氢离子生成氢气,阴极电极反应式为2H2O+2e-═H2↑+2OH-,A口出来的是氢气,b极应接电源正极,阳极电极反应式为SO32--2e-+H2O═SO42-+2H+,所以A口放出的物质是氢气,从C口流出的是浓度较大的硫酸,故B错误;
C、b为阳极,SO32-在阳极失去电子变成SO42-,阳极电极反应式为SO32--2e-+H2O═SO42-+2H+,故C正确;
D、在阴极区,由于H+放电,破坏水的电离平衡,c(H+)减小,c(OH-)增大,生成NaOH,碱性增强,故D正确.
故选B.
点评 本题考查了电解的原理,明确电解池工作原理是解题关键,根据阴阳离子的移动方向判断电极,注意电解质电极判断的方法和电极反应式书写注意问题为易错点.

练习册系列答案
相关题目
20.由Zn,Fe,Al,Mg四种金属中的两种组成的混合物10g,与足量的盐酸反应产生的氢气在标况下为11.2升,则混合物中的组成可能是( )
| A. | Zn、Fe | B. | Fe、Mg | C. | Al、Mg | D. | Zn、Mg |
1.下列实验的解释或结论正确的是( )
| 选项 | 实验 | 解释或结论 |
| A | 向包有Na2O2的脱脂棉滴少量水,脱脂棉燃烧 | Na2O2与H2O反应放热并有O2生成 |
| B | 向NaI溶液滴加FeCl3溶液,再加入CCl4,振荡,静置,下层呈紫红色 | 氧化性:I2>Fe3+ |
| C | 取酸雨试样,滴加H2O2溶液,再加入BaCl2溶液,有白色沉淀 | 该酸雨试样中一定含有H2SO3 |
| D | 用激光笔照射水玻璃(Na2SiO3的溶液),有丁达尔现象 | SiO32-水解生成了硅酸胶体 |
| A. | A | B. | B | C. | C | D. | D |
15.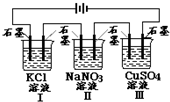 如图装置电解一段时间,当某极析出0.32g Cu时,I、Ⅱ、Ⅲ中溶液pH分别为(溶液足量,体积均为100mL且电解前后溶液体积变化忽略不计)( )
如图装置电解一段时间,当某极析出0.32g Cu时,I、Ⅱ、Ⅲ中溶液pH分别为(溶液足量,体积均为100mL且电解前后溶液体积变化忽略不计)( )
 如图装置电解一段时间,当某极析出0.32g Cu时,I、Ⅱ、Ⅲ中溶液pH分别为(溶液足量,体积均为100mL且电解前后溶液体积变化忽略不计)( )
如图装置电解一段时间,当某极析出0.32g Cu时,I、Ⅱ、Ⅲ中溶液pH分别为(溶液足量,体积均为100mL且电解前后溶液体积变化忽略不计)( )| A. | 12、7、2 | B. | 13、7、1 | C. | 1、7、13 | D. | 7、13、1 |
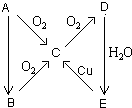 A、B、C、D、E五种物质在一定条件下的转化关系如图所示.
A、B、C、D、E五种物质在一定条件下的转化关系如图所示. 连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体.
连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体.