题目内容
2.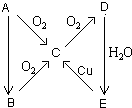 A、B、C、D、E五种物质在一定条件下的转化关系如图所示.
A、B、C、D、E五种物质在一定条件下的转化关系如图所示.(1)若A在常温下为气态单质,则A为N2;B为NH3;C为NO;
D为NO2;E为HNO3;由B→C变化的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$NO+6H2O
(2)若A在常温下为固态单质.则B→C变化的化学方程式2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O.
分析 由转化关系可知,中学常见N、S元素单质化合物符合转化.
(1)若A在常温下为气态单质,A为N2,B为NH3,C为NO,D为NO2,E为HNO3;
(2)若A在常温下为气态单质,A为S,B为H2S,C为SO2,D为NO2,E为H2SO4.
解答 解:由转化关系可知,中学常见N、S元素单质化合物符合转化.
(1)若A在常温下为气态单质,A为N2,B为NH3,C为NO,D为NO2,E为HNO3.由B→C变化的化学方程式:4NH3+5O2$\frac{\underline{催化剂}}{△}$NO+6H2O,
故答案为:N2;NH3;NO;NO2;HNO3;4NH3+5O2$\frac{\underline{催化剂}}{△}$NO+6H2O;
(2)若A在常温下为气态单质,A为S,B为H2S,C为SO2,D为NO2,E为H2SO4.则B→C变化的化学方程式为:2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O,
故答案为:2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O.
点评 本题考查无机物推断,涉及氮、硫元素单质化合物性质,难度不大,注意掌握中学常见连续反应,熟练掌握元素化合物性质.

练习册系列答案
相关题目
12.关于氢键的下列说法中正确的是( )
| A. | 每个水分子内含有两个氢键 | |
| B. | 只要有氢元素就能形成氢键 | |
| C. | 分子间能形成氢键使物质的熔点和沸点升高 | |
| D. | HF的稳定性很强,是因为其分子间能形成氢键 |
13.下列关于乙烯和乙烷的说法正确的是( )
| A. | 乙烷可与氯气反应制取纯净的一氯乙烷 | |
| B. | 乙烯可以使溴水褪色 | |
| C. | 乙烷和乙烯互为同分异构体 | |
| D. | 乙烯制备聚乙烯是物理变化 |
10.用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示(电极材料为石墨).下列有关叙述不正确的是( )
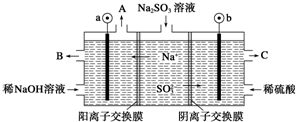

| A. | 图中a极连接电源的负极 | |
| B. | A口放出的物质是氢气,C口放出的物质是氧气 | |
| C. | b极电极反应式为:SO32--2e-+H2O═SO42-+2H+ | |
| D. | 电解过程中阴极区碱性明显增强 |
17.室温下,用0.10mol•L-1盐酸分别滴定20.00mL 0.10mol•L-1氢氧化钠溶液和氨水,滴定过程中溶液pH随加入盐酸体积V(HCl)的变化关系如图.下列说法不正确的是( )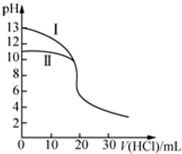

| A. | Ⅱ表示的是滴定氨水的曲线,当V(HCl)=20 mL时:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 当pH=7时,滴定氨水消耗的V(HCl)<20 mL,且c(NH4+)=c(Cl-) | |
| C. | 滴定氢氧化钠溶液时,若V(HCl)>20 mL,则一定有:c(Cl-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 当滴定氨水消耗V(HCl)=10 mL时,有:2[c(OH-)-c(H+)]=c(NH4+)-c(NH3•H2O) |
14.下列事故的处理错误的是( )
| A. | 将CO中毒者移到通风处抢救 | |
| B. | 不慎将浓硫酸溅到皮肤上,应立即用少量水冲洗 | |
| C. | 不慎碰倒酒精灯,洒出的酒精在桌上燃烧时,应立即用湿抹布盖灭 | |
| D. | 眼睛里不慎溅进了药液,应立即用水冲洗,边洗边眨眼睛,不可用手揉 |
11.下列事实中,能说明B(OH)2是弱碱的是( )
| A. | 等体积的0.010mol/LB(OH)2溶液与0.010mol/LH2SO4溶液恰好完全反应 | |
| B. | 0.010mol/LB(OH)2溶液能使红色石蕊试液变蓝 | |
| C. | 0.010mol/LBCl2溶液呈酸性,0.010mol/LB2CO3溶液呈中性 | |
| D. | 0.010mol/LB(OH)2溶液能够与NH4Cl反应生成NH3(g) |
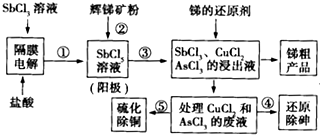 我国锑的蕴藏量占世界第一位,辉锑矿(Sb2S3)是其主要矿物.某冶金课题组设计的一种提取锑的工艺流程如图.
我国锑的蕴藏量占世界第一位,辉锑矿(Sb2S3)是其主要矿物.某冶金课题组设计的一种提取锑的工艺流程如图. 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H20).
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H20).