题目内容
15.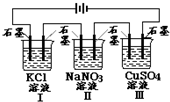 如图装置电解一段时间,当某极析出0.32g Cu时,I、Ⅱ、Ⅲ中溶液pH分别为(溶液足量,体积均为100mL且电解前后溶液体积变化忽略不计)( )
如图装置电解一段时间,当某极析出0.32g Cu时,I、Ⅱ、Ⅲ中溶液pH分别为(溶液足量,体积均为100mL且电解前后溶液体积变化忽略不计)( )| A. | 12、7、2 | B. | 13、7、1 | C. | 1、7、13 | D. | 7、13、1 |
分析 由离子放电顺序可知,电解时,I、Ⅱ、Ⅲ中溶液电极方程式分别为2KCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2KOH+H2↑+Cl2↑、2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑、2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,由铜的质量计算转移电子的物质的量,进而计算各溶液的pH.
解答 解:n(Cu)=$\frac{0.32g}{64g/mol}$=0.005mol,由电极反应Cu2++2e-=Cu可知转移电子为0.01mol,
电解时,I、Ⅱ、Ⅲ中溶液电极方程式分别为2KCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2KOH+H2↑+Cl2↑、2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑、2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,
I中生成0.01molOH-,c(OH-)=$\frac{0.01mol}{0.1L}$=0.1mol/L,pH=13,
Ⅱ电解水,溶液呈中性,pH=7,
Ⅲ中生成0.01molH+,c(H+)=$\frac{0.01mol}{0.1L}$=0.1mol/L,pH=1,
故选B.
点评 本题考查电解原理,侧重于学生的分析能力和计算能力的考查,为高考高频考点,难度中等,注意把握离子的放电顺序以及电解方程式的书写,为解答该题的关键.

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
5.锰酸锂(LiMn2O4)是新一代锂离子电池的正极材料.实验室回收利用废旧锂离子电池正极材料(锰酸锂、碳粉等涂覆在铝箔上)的一种流程如下:
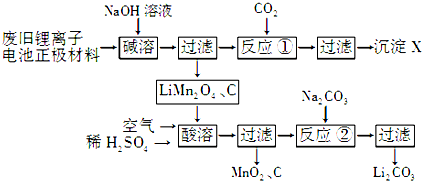
(1)X的化学式为Al(OH)3.
(2)写出“酸溶”过程中反应的离子方程式:4LiMn2O4+O2+4H+═4Li++8MnO2+2H2O.
(3)反应②中与Na2CO3反应的物质有Li2SO4和H2SO4(填化学式);工业上洗涤Li2CO3用的是热水而不是冷水,其原因是降低Li2CO3的溶解度,减少溶解.
(4)固相法制备LiMn2O4的实验过程如下:将MnO2和Li2CO3按4:1的物质的量之比配料,球磨3~5小时,然后升温,高温加热,保温24小时,冷却至室温.
①写出该反应的化学方程式:8MnO2+2Li2CO3$\frac{\underline{\;高温\;}}{\;}$4LiMn2O4+2CO2↑+O2↑.
②LiMn2O4中锰元素的平均价态为+3.5.在不同温度下,合成的LiMn2O4中Mn2+、Mn3+和Mn4+的含量与温度的关系见下表.
由此可以确定:在上述温度范围内,锰元素的平均价态的变化趋势是先变大,后变小.

(1)X的化学式为Al(OH)3.
(2)写出“酸溶”过程中反应的离子方程式:4LiMn2O4+O2+4H+═4Li++8MnO2+2H2O.
(3)反应②中与Na2CO3反应的物质有Li2SO4和H2SO4(填化学式);工业上洗涤Li2CO3用的是热水而不是冷水,其原因是降低Li2CO3的溶解度,减少溶解.
(4)固相法制备LiMn2O4的实验过程如下:将MnO2和Li2CO3按4:1的物质的量之比配料,球磨3~5小时,然后升温,高温加热,保温24小时,冷却至室温.
①写出该反应的化学方程式:8MnO2+2Li2CO3$\frac{\underline{\;高温\;}}{\;}$4LiMn2O4+2CO2↑+O2↑.
②LiMn2O4中锰元素的平均价态为+3.5.在不同温度下,合成的LiMn2O4中Mn2+、Mn3+和Mn4+的含量与温度的关系见下表.
| T/℃ | w(Mn2+)(%) | w(Mn3+)(%) | w(Mn4+)(%) |
| 700 | 5.56 | 44.58 | 49.86 |
| 750 | 2.56 | 44.87 | 52.57 |
| 800 | 5.50 | 44.17 | 50.33 |
| 850 | 6.22 | 44.40 | 49.38 |
6.关于下列物质的关系中不正确的是( )
| A. | 金刚石与石墨互为同素异形体 | B. | H、D、T互为同位素 | ||
| C. | CH3-CH3与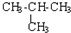 互为同系物 互为同系物 | D. | 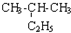 与 与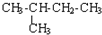 互为同分异构体 互为同分异构体 |
10.用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示(电极材料为石墨).下列有关叙述不正确的是( )
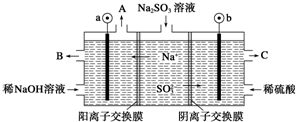

| A. | 图中a极连接电源的负极 | |
| B. | A口放出的物质是氢气,C口放出的物质是氧气 | |
| C. | b极电极反应式为:SO32--2e-+H2O═SO42-+2H+ | |
| D. | 电解过程中阴极区碱性明显增强 |
20.标准状况下有以下四种气体:①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3.下列关系不正确的是( )
| A. | 体积:④<①<③<② | B. | 质量:④<①<③<② | ||
| C. | 物质的量:①<②<③<④ | D. | 氢原子数:②<④<③<① |
4.科学家预言,燃料电池将是 21 世纪获得电能的重要途径.近几年开发的甲醇燃料电池是采用铂作电极催化剂,工作原理是将电极插入KOH溶液中,然后在两极分别添加甲醇和氧气,若a极上添加甲醇; b极:2H2O+O2+4e-═4OH-. 关于此燃料电池的下列说法中错误的是( )
| A. | a极为负极,b极为正极 | |
| B. | 放电过程中,a、b电极上均发生氧化还原反应 | |
| C. | 该电池工作时添加甲醇的一极,附近溶液的 pH 降低,反应的离子方程式为:CH3OH+8OH--6e-═CO32-+6H2O | |
| D. | 若用此电源电解饱和食盐水,每消耗 0.1molO2则阳极理论上生成 0.2molCl2. |
5.下列物质有颜色的是( )
| A. | 食盐溶液 | B. | 氯化钙溶液 | C. | 苏打水 | D. | 饱和氯水 |
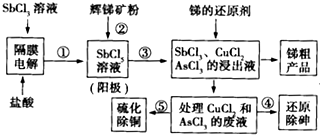 我国锑的蕴藏量占世界第一位,辉锑矿(Sb2S3)是其主要矿物.某冶金课题组设计的一种提取锑的工艺流程如图.
我国锑的蕴藏量占世界第一位,辉锑矿(Sb2S3)是其主要矿物.某冶金课题组设计的一种提取锑的工艺流程如图.