题目内容
对于常温下pH=3的乙酸溶液,下列说法正确的是( )
| A、溶液中粒子浓度大小关系为:c(H+)>c(CH3COO-)>c(CH3COOH)>c(OH-) |
| B、加水稀释到原体积的10倍后溶液pH变为4 |
| C、加入少量乙酸钠固体,溶液pH升高 |
| D、与等体积、pH=3的盐酸比较,跟足量锌粒反应产生的H2一样多 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A、乙酸在溶液中部分电离,溶液显酸性,溶液中的氢离子浓度大于醋酸根离子浓度;
B、乙酸是弱电解质存在电离平衡,加水稀释促进电离;
C、依据电离平衡移动方向分析判断;
D、乙酸是弱电解质,在溶液中部分电离.
B、乙酸是弱电解质存在电离平衡,加水稀释促进电离;
C、依据电离平衡移动方向分析判断;
D、乙酸是弱电解质,在溶液中部分电离.
解答:
解:A、乙酸在溶液中部分电离,溶液显酸性,溶液中的氢离子浓度大于醋酸根离子浓度,溶液中粒子浓度大小关系为c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-),故A错误;
B、加水稀释到原体积的10倍后溶液pH变为4,但乙酸是弱电解质存在电离平衡,稀释促进电离,溶液又电离出氢离子,浓度增大,溶液pH小于4,故B错误;
C、乙酸钠溶于水溶液中的乙酸根离子抑制乙酸的电离,平衡左移,氢离子浓度减小,溶液pH增大,故C正确;
D、乙酸是弱电解质,在溶液中部分电离,则c(CH3COOH)>c(H+),盐酸中c(HCl)=c(H+),所以等体积、等pH的二者醋酸的物质的量大,则与足量锌粒反应醋酸产生的H2更多,故D错误;
故选C.
B、加水稀释到原体积的10倍后溶液pH变为4,但乙酸是弱电解质存在电离平衡,稀释促进电离,溶液又电离出氢离子,浓度增大,溶液pH小于4,故B错误;
C、乙酸钠溶于水溶液中的乙酸根离子抑制乙酸的电离,平衡左移,氢离子浓度减小,溶液pH增大,故C正确;
D、乙酸是弱电解质,在溶液中部分电离,则c(CH3COOH)>c(H+),盐酸中c(HCl)=c(H+),所以等体积、等pH的二者醋酸的物质的量大,则与足量锌粒反应醋酸产生的H2更多,故D错误;
故选C.
点评:本题考查了弱电解质的电离平衡分析判断,溶液中Kw的应用,影响因素的分析等,侧重于基础知识的考查,题目难度不大.

练习册系列答案
相关题目
NaCl是一种重要的化工原料,如图所示,可以制备一系列物质.下列说法正确的是( )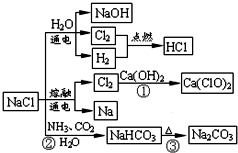

| A、反应②③是侯氏制碱法的原理 |
| B、反应①中的Ca(ClO)2是还原产物 |
| C、常温下干燥Cl2可储存于钢瓶中,所以Cl2与铁不反应 |
| D、图中所示转化反应都是氧化还原反应 |
下列各组离子中,在强碱性溶液中能共存,且在加入盐酸过程中会产生气体和沉淀的是( )
| A、Na+、NO3-、AlO2-、SO42- |
| B、Na+、Al3+、NO3-、SO42- |
| C、Na+、Mg2+、Cl-、HCO3- |
| D、K+、Cl-、AlO2-、CO32- |
室温下,甲、乙两烧杯均盛有5mLpH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4.关于甲、乙两烧杯中溶液的描述正确的是( )
| A、水电离出的OH-浓度:10c(OH-)甲≤c(OH-)乙 |
| B、溶液的体积:10V甲≤V乙 |
| C、若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙 |
| D、若分别与5mLpH=11的NaOH溶液反应,所得溶液的pH:甲≥乙 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、标准状况下,22.4 L H2O含有的分子数为NA |
| B、500mL1moL/L的盐酸溶液中含有的HCl分子数为0.5NA |
| C、将1L2mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA |
| D、23gNa与O2在不同条件下反应虽分别生成Na2O和Na2O2,但转移的电子数一定为 NA |
观察如图装置,下列说法正确的是( )
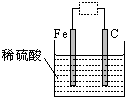

| A、虚线框中接灵敏电流计,铁被腐蚀,并能将电能转化为化学能 |
| B、虚线框中保持断开状态,铁可能不会被腐蚀 |
| C、虚线框中接直流电源,铁可能不会被腐蚀 |
| D、虚线框中无论接灵敏电流计还是直流电源,铁都会加快腐蚀 |
下列说法正确的是( )
| A、需要加热的化学反应都是吸热反应 |
| B、水力发电是将化学能转化为电能的过程 |
| C、某吸热反应能自发进行,因此该反应是熵增反应 |
| D、原电池是将电能转化为化学能的一种装置 |