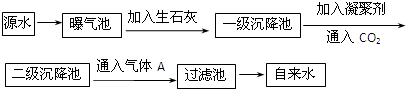
题目内容
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、标准状况下,22.4 L H2O含有的分子数为NA |
| B、500mL1moL/L的盐酸溶液中含有的HCl分子数为0.5NA |
| C、将1L2mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA |
| D、23gNa与O2在不同条件下反应虽分别生成Na2O和Na2O2,但转移的电子数一定为 NA |
考点:阿伏加德罗常数
专题:
分析:A.标准状况下,水是液体;
B.盐酸中没有HCl分子;
C.铁离子的水解为可逆反应,且胶体粒子为氢氧化铁的聚集体无法计算溶液中胶粒数目
D.23gNa为1mol,转移的电子数一定为 NA.
B.盐酸中没有HCl分子;
C.铁离子的水解为可逆反应,且胶体粒子为氢氧化铁的聚集体无法计算溶液中胶粒数目
D.23gNa为1mol,转移的电子数一定为 NA.
解答:
解:A.标准状况下,水是液体,不能用气体摩尔体积计算水的物质的量,故A错误;
B.盐酸中没有HCl分子,存在氯离子、氢离子,故B错误;
C.铁离子的水解为可逆反应,1mol氯化铁中,参加水解的生成氢氧化铁的铁离子小于1mol,且氢氧化铁胶体粒子为氢氧化铁聚集体,所以生成的氢氧化铁胶粒一定小于1mol,故C错误;
D.23gNa为1mol,与O2在不同条件下反应虽分别生成Na2O和Na2O2,但转移的电子数一定为 NA,故D正确;
故选D.
B.盐酸中没有HCl分子,存在氯离子、氢离子,故B错误;
C.铁离子的水解为可逆反应,1mol氯化铁中,参加水解的生成氢氧化铁的铁离子小于1mol,且氢氧化铁胶体粒子为氢氧化铁聚集体,所以生成的氢氧化铁胶粒一定小于1mol,故C错误;
D.23gNa为1mol,与O2在不同条件下反应虽分别生成Na2O和Na2O2,但转移的电子数一定为 NA,故D正确;
故选D.
点评:本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项D为易错点,注意氢氧化铁胶粒为氢氧化铁的聚集体.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
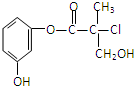 某有机物A是生产有机农药“杀螨灵”的一种中间体,其结构简式如图.则下列叙述正确的是( )
某有机物A是生产有机农药“杀螨灵”的一种中间体,其结构简式如图.则下列叙述正确的是( )| A、有机物A属于芳香烃 |
| B、有机物A与 Br2的CCl4溶液容易发生加成反应 |
| C、有机物A和浓硫酸混合加热,可以发生消去反应 |
| D、1mol A和足量的NaOH溶液反应,最多可以消耗4mol NaOH |
对于常温下pH=3的乙酸溶液,下列说法正确的是( )
| A、溶液中粒子浓度大小关系为:c(H+)>c(CH3COO-)>c(CH3COOH)>c(OH-) |
| B、加水稀释到原体积的10倍后溶液pH变为4 |
| C、加入少量乙酸钠固体,溶液pH升高 |
| D、与等体积、pH=3的盐酸比较,跟足量锌粒反应产生的H2一样多 |
可逆反应mA(固)+nB(气)?Pc (气)+qD(气)反应过程中其他条件不变时C的百分含量C%与温度(T)和压强(p)的关系如图所示,下列叙述中正确的是( )
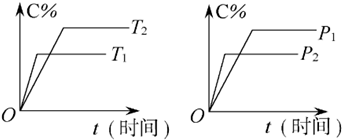

| A、达到平衡后,使用催化剂,C%将增大 |
| B、达到平衡后,若升高温度,化学平衡向逆反应方向移动 |
| C、方程式中n>p+q |
| D、达到平衡后,增加A的量有利于化学平衡向正反应方向移动 |
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )


| A、反应开始2分钟内平均反应速率最大 |
| B、反应4分钟后平均反应速率最小 |
| C、反应开始4分钟内温度对反应速率的影响比浓度大 |
| D、反应在第2min到第4min间生成CO2的平均反应速率最大 |
下列关于平衡常数K的说法中,正确的是( )
| A、在任何条件下,化学平衡常数是一个恒定值 |
| B、从平衡常数K的大小可以推断一个反应进行的程度 |
| C、平衡常数K只与温度有关,与反应起始浓度、压强无关 |
| D、改变反应物浓度或生成物浓度都会改变平衡常数K |
下列关于配合物的叙述中,不正确的是( )
| A、配合物中必定存在配位键 |
| B、配合物中只有配位键 |
| C、[Cu(H2O)6]2+中的Cu2+提供空轨道,H2O中的氧原子提供孤电子对形成配位键 |
| D、配合物在半导体等尖端技术、医学科学、催化反应和材料化学等领域都有着广泛的应用 |