题目内容
下列各组离子中,在强碱性溶液中能共存,且在加入盐酸过程中会产生气体和沉淀的是( )
| A、Na+、NO3-、AlO2-、SO42- |
| B、Na+、Al3+、NO3-、SO42- |
| C、Na+、Mg2+、Cl-、HCO3- |
| D、K+、Cl-、AlO2-、CO32- |
考点:离子共存问题
专题:离子反应专题
分析:碱性溶液中离子之间不能结合生成水、气体、沉淀等,离子能够共存,加酸生成气体、沉淀,以此来解答.
解答:
解:A.该组离子之间不反应,能共存,加酸只能生成氢氧化铝沉淀,故A不选;
B.碱性条件下Al3+不能大量共存,故B不选;
C.碱性条件下,Mg2+、HCO3-不能大量共存,分别生成沉淀、碳酸根离子和水,故C不选;
D.该组离子之间不反应,能共存,加酸生成二氧化碳气体和氢氧化铝沉淀,故D选.
故选D.
B.碱性条件下Al3+不能大量共存,故B不选;
C.碱性条件下,Mg2+、HCO3-不能大量共存,分别生成沉淀、碳酸根离子和水,故C不选;
D.该组离子之间不反应,能共存,加酸生成二氧化碳气体和氢氧化铝沉淀,故D选.
故选D.
点评:本题考查离子的共存问题,为高频考点,侧重于学生的分析能力的考查,明确信息及信息的应用是解答本题的关键,熟悉复分解反应发生的条件及离子之间的反应即可解答,难度不大.

练习册系列答案
相关题目
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是( )
①向饱和碳酸钠溶液中通入过量CO2
②向NaAlO2溶液中逐滴加入过量的稀盐酸
③向AlCl3溶液中逐滴加入过量稀NaOH溶液
④向硅酸钠溶液中逐滴加入过量的盐酸
⑤向AgNO3溶液中逐滴加入稀氨水.
①向饱和碳酸钠溶液中通入过量CO2
②向NaAlO2溶液中逐滴加入过量的稀盐酸
③向AlCl3溶液中逐滴加入过量稀NaOH溶液
④向硅酸钠溶液中逐滴加入过量的盐酸
⑤向AgNO3溶液中逐滴加入稀氨水.
| A、①② | B、②③ | C、①④ | D、④⑤ |
 某有机物A是生产有机农药“杀螨灵”的一种中间体,其结构简式如图.则下列叙述正确的是( )
某有机物A是生产有机农药“杀螨灵”的一种中间体,其结构简式如图.则下列叙述正确的是( )| A、有机物A属于芳香烃 |
| B、有机物A与 Br2的CCl4溶液容易发生加成反应 |
| C、有机物A和浓硫酸混合加热,可以发生消去反应 |
| D、1mol A和足量的NaOH溶液反应,最多可以消耗4mol NaOH |
海水是一个巨大的化学资源宝库,下列有关海水综合利用的说法,正确的是( )
| A、海水中含有镁元素,只需经过物理变化就可以得到镁单质 |
| B、海水蒸发制海盐的过程中只发生了化学变化 |
| C、从海水中可以得到NaCl,电解NaCl溶液可得到金属钠 |
| D、从海水中提取Br2、I2的过程中发生了氧化还原反应 |
对于常温下pH=3的乙酸溶液,下列说法正确的是( )
| A、溶液中粒子浓度大小关系为:c(H+)>c(CH3COO-)>c(CH3COOH)>c(OH-) |
| B、加水稀释到原体积的10倍后溶液pH变为4 |
| C、加入少量乙酸钠固体,溶液pH升高 |
| D、与等体积、pH=3的盐酸比较,跟足量锌粒反应产生的H2一样多 |
可逆反应mA(固)+nB(气)?Pc (气)+qD(气)反应过程中其他条件不变时C的百分含量C%与温度(T)和压强(p)的关系如图所示,下列叙述中正确的是( )
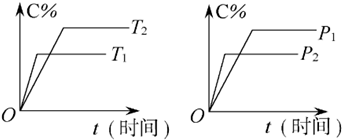

| A、达到平衡后,使用催化剂,C%将增大 |
| B、达到平衡后,若升高温度,化学平衡向逆反应方向移动 |
| C、方程式中n>p+q |
| D、达到平衡后,增加A的量有利于化学平衡向正反应方向移动 |
下列关于平衡常数K的说法中,正确的是( )
| A、在任何条件下,化学平衡常数是一个恒定值 |
| B、从平衡常数K的大小可以推断一个反应进行的程度 |
| C、平衡常数K只与温度有关,与反应起始浓度、压强无关 |
| D、改变反应物浓度或生成物浓度都会改变平衡常数K |
