题目内容
7.下列有关氯水的叙述,正确的是( )| A. | 新制氯水只含有氯分子和次氯酸分子 | |
| B. | 新制氯水可使紫色石蕊试液先变红后褪色 | |
| C. | 氯水光照时有气泡逸出,该气体的主要成分是氯气 | |
| D. | 氯水放置数天后,其酸性逐渐减弱 |
分析 A.氯水中含水、氯气、HClO三种分子;
B.依据氯水中含有氢离子和次氯酸分子解答;
C.氯水中次氯酸不稳定,见光分解生成氯化氢和氧气;
D.氯水放置数天后,HClO分解生成盐酸.
解答 解:A.氯水中含水、氯气、HClO三种分子,故A错误;
B.氯水中含有氢离子和次氯酸分子,具有酸性和漂白性,所以可使紫色石蕊试液先变红后褪色,故B正确;
C.氯水中次氯酸不稳定,见光分解生成氯化氢和氧气,所以逸出气体的主要成分是氧气,故C错误;
D.氯水放置数天后,HClO分解生成盐酸,则酸性逐渐增强,故D错误;
故选:B.
点评 本题考查氯气及氯气的性质,为高频考点,把握氯水的成分、氯气和HClO的性质为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
18.亚硝酸(HNO2)既可作氧化剂又可作还原剂,当它在反应中作还原剂时,可能生成的产物是( )
| A. | N2 | B. | N2O3 | C. | NH3 | D. | NO2 |
15. 在一密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0,如图表示该反应的速率(v)在某一时间段内的变化.则下列时间段中,SO3的百分含量最高的是( )
在一密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0,如图表示该反应的速率(v)在某一时间段内的变化.则下列时间段中,SO3的百分含量最高的是( )
 在一密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0,如图表示该反应的速率(v)在某一时间段内的变化.则下列时间段中,SO3的百分含量最高的是( )
在一密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0,如图表示该反应的速率(v)在某一时间段内的变化.则下列时间段中,SO3的百分含量最高的是( )| A. | t0→t1 | B. | t2→t3 | C. | t3→t4 | D. | t3→t5 |
2. 氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂,但不能导电.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.关于这两种晶体的说法,正确的是( )
氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂,但不能导电.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.关于这两种晶体的说法,正确的是( )
 氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂,但不能导电.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.关于这两种晶体的说法,正确的是( )
氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂,但不能导电.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.关于这两种晶体的说法,正确的是( )| A. | 立方相氮化硼含配位键B→N | |
| B. | 六方相氮化硼层间作用力小,所以质地软,熔点低 | |
| C. | 两种氮化硼中的硼原子都是采用sp2杂化 | |
| D. | 六方相氮化硼晶体其结构与石墨相似却不导电,原因是没有可以自由移动的电子 |
12.下列关于各图的说法,正确的是( )
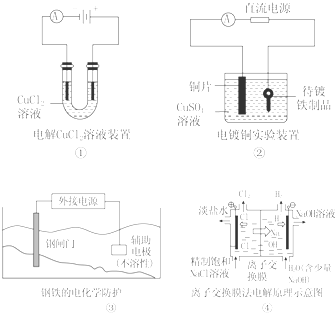

| A. | ①中阴极处能产生使湿润淀粉KI试纸变蓝的气体 | |
| B. | ②中待镀铁制品应与电源正极相连 | |
| C. | ③中钢闸门应与外接电源的正极相连 | |
| D. | ④中的离子交换膜可以避免生成的Cl2与NaOH溶液反应 |
19.欲检验在制得的HCl气体中是否混有少量Cl2的方法是( )
| A. | 用酚酞试纸 | B. | 用湿润的蓝色石蕊试纸 | ||
| C. | 用硝酸银溶液 | D. | 用湿润的淀粉-KI试纸 |
16.常温时将pH=8的NaOH与pH=10的NaOH溶液等体积混合,溶液反应后c(H+)最接近于( )
| A. | (10-8+10-10)mol•L-1 | B. | (10-4+10-6)mol•L-1 | ||
| C. | (10-6+10-10)mol•L-1 | D. | 2×10-10 mol•L-1 |
17. 已知反应:2SO2(g)+O2(g)?2SO3(g)△H<0.一定温度下,在容积为2L的甲、乙、丙三个恒温密闭容器中,充入的SO2(g)和O2(g)的量如图所示:
已知反应:2SO2(g)+O2(g)?2SO3(g)△H<0.一定温度下,在容积为2L的甲、乙、丙三个恒温密闭容器中,充入的SO2(g)和O2(g)的量如图所示:
下列判断正确的是( )
 已知反应:2SO2(g)+O2(g)?2SO3(g)△H<0.一定温度下,在容积为2L的甲、乙、丙三个恒温密闭容器中,充入的SO2(g)和O2(g)的量如图所示:
已知反应:2SO2(g)+O2(g)?2SO3(g)△H<0.一定温度下,在容积为2L的甲、乙、丙三个恒温密闭容器中,充入的SO2(g)和O2(g)的量如图所示:下列判断正确的是( )
| A. | 三个容器中的反应速率相同 | |
| B. | 丙中的平衡常数最大,甲中最小 | |
| C. | 当容器甲中SO2的转化率为80%时,该反应的平衡常数为160 | |
| D. | 达到平衡时,容器丙中的c(SO3)是容器甲中的两倍 |
 已知:0.4mol液态N2H4与足量的液体双氧水反应,生成氮气和水蒸气,放出200.0kJ的热量.
已知:0.4mol液态N2H4与足量的液体双氧水反应,生成氮气和水蒸气,放出200.0kJ的热量.