题目内容
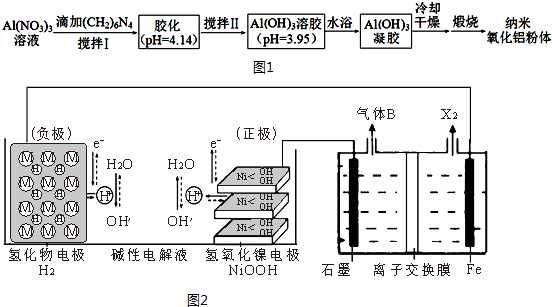
6. 某课外兴趣小组测定某未知浓度的NaOH溶液时,他们的测定过程大体如下:
某课外兴趣小组测定某未知浓度的NaOH溶液时,他们的测定过程大体如下:①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00ml待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净后,向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂刚好变色,且并不马上褪色为止,测得所耗盐酸的体积为V1mL.
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积為V2ml.
⑤由于某种原因,该兴趣小组做完第①步后,第二天(部分NaOH溶液与空气中CO2反应)再从第②步开始继续进行滴定,测得所耗盐酸的体积为V3ml.
试回答下列问题:
(1)锥形瓶中的溶液从红色变为无色时,即可终止滴定.
(2)该小组在①步骤中的错误是用待测液润洗了锥形瓶 他们的测定结果是偏高(偏高、偏低或无影响)
(3)在②步骤中的错误是没有用盐酸润洗酸式滴定管,他们的测定结果是偏高(偏高、偏低或无影响)
(4)如图,是第一次滴定时的滴定管中的液面,其读数为22.60
(5)下列说法中正确的是c
a、滴定管下端带有玻璃活塞的是碱式滴定管
b、滴定操作时,用左手摇动锥形瓶,右手控制滴定管
c、滴定管在滴定前都应先排除尖嘴部分的空气泡
d、滴定时两眼应注视滴定管中液面的变化,以免滴定过量.
分析 (1)根据标准酸滴定NaOH溶液,以酚酞作指示剂,滴定终点颜色的变化;
(2)根据锥形瓶装液前不能润洗,否则待测液的物质的量偏大;根据C(待测)=$\frac{C(标准)×V(标准)}{V(待测)}$判断不当操作对V(标准)的影响;
(3)将酸式滴定管用蒸馏水洗净后,立即向其中注入标准稀溶液,则标准溶液的浓度偏小,所以要用标准溶液润洗;根据C(待测)=$\frac{C(标准)×V(标准)}{V(待测)}$判断不当操作对V(标准)的影响;
(4)根据滴定管的结构和精确度;
(5)a、滴定管下端带有玻璃活塞的是酸式滴定管;滴定管下端带有橡皮管的是碱式滴定管;
b、滴定操作时,用左手控制滴定管,右手摇动锥形瓶;
c、滴定管装液后要排气泡;
d、滴定时两眼应注视锥形瓶溶液颜色变化;
解答 解:(1)标准酸滴定NaOH溶液,以酚酞作指示剂,滴定终点时,溶液的颜色由红色变为无色,且半分钟内不变色;
故答案为:红;无;
(2)锥形瓶装液前不能润洗,否则待测液的物质的量偏大,影响测定结果;若锥形瓶用待测液润洗,待测液的物质的量偏多,造成V(标准)增大,根据C(待测)=$\frac{C(标准)×V(标准)}{V(待测)}$判断,测定结果偏高;
故答案为:用待测液润洗了锥形瓶;偏高;
(3)将酸式滴定管用蒸馏水洗净后,立即向其中注入标准稀溶液,则标准溶液的浓度偏小,所以在②步骤中的错误是没有用盐酸润洗酸式滴定管;
将酸式滴定管用蒸馏水洗净后,立即向其中注入标准稀溶液,则标准溶液的浓度偏小,造成V(标准)偏大,根据C(待测)=$\frac{C(标准)×V(标准)}{V(待测)}$判断,测定结果偏高;
故答案为:没有用盐酸润洗酸式滴定管;偏高;
(4)滴定时的滴定管中的液面,其读数为22.60mL,故答案为:22.60mL;
(5)a、滴定管下端带有玻璃活塞的是酸式滴定管,故a错误;
b、滴定操作时,用左手控制滴定管,右手摇动锥形瓶,故b正确;
c、滴定管在滴定前都应先排除尖嘴部分的空气泡,然后读数,故c错误;
d、滴定时两眼应注视锥形瓶溶液颜色变化,以判断滴定终点,故d错误;
故选c;
点评 本题主要考查了中和滴定操作、误差分析以及计算,难度不大,理解中和滴定的原理是解题关键.

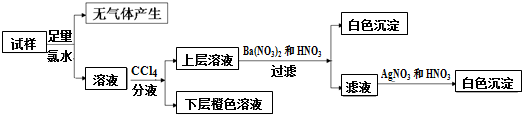
| A. | 若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响 | |
| B. | 无法确定原溶液中是否存在Cl- | |
| C. | 肯定存在的离子是SO32-、Br-,是否存在Na+、K+需要通过焰色反应来确定 | |
| D. | 肯定不存在的离子是Mg2+、Cu2+、SO42-、CO32-,是否含NH4+另需实验验证 |
| A. | 向Na2CO3溶液中加入等浓度等体积的盐酸:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | NaHS溶液中:c(OH-)+c(S2-)=c(H+)+c(H2S) | |
| C. | pH相同的①CH3COONa溶液、②NaClO溶液中c(Na+):①<② | |
| D. | pH=9的0.1mol•L-1的NaHR溶液中:c(HR-)>c(H+)>c(R2-)>c(H2R) |
(1)依据题给条件.你认为他们能完成哪些因素对速率形响的探究?HNO3浓度、温度、大理石的表面积.
(2)请根据(I)中选择的探究内容.填写以下实验设计表.完成探究实验:
| 实验编号 | T/℃ | 大理石规格 | HNO3浓度/mol•L-1 |
| ① | 常温 | 2.00 | |
| ② | 1.00 | ||
| ③ | 2.00 | ||
| ④ | 2.00 |
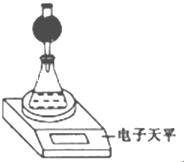 (3)整个实验中应控制的不变量是硝酸溶液体积和CaCO3质量.
(3)整个实验中应控制的不变量是硝酸溶液体积和CaCO3质量.(4)该实验小组用如图实验装置进行实验.
①除电于天平、干燥管、锥形瓶、药匙、胶塞等仪器外.必需的实验仪器还有量筒、秒表.干燥管中放置的试剂可以是bc(填序号).
a.碱石灰 b.无水CaCl2 c.P2O5固体 d.浓硫酸
③若撤除干燥管装置,所测速率偏大(填“偏大”“偏小”或“不变”).
| A. | AgCl沉淀生成和溶解同时在不断进行,且速率相等 | |
| B. | AgCl难溶于水,则溶液中没有Ag+和Cl- | |
| C. | 只要向含有AgCl的饱和溶液中加入盐酸,一定会有沉淀生成 | |
| D. | 向含有AgCl的悬浊液中加入NaBr固体,AgCl沉淀不变化 |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
 原子序数小于36的X、Y、Z和铜四种元素,X的基态原子有3个不同的能级,有一个能级中的电子数比其它两个能级的中电子数都多1;Y基态原子中的电子占有5个轨道,其中有2个轨道处于半满状态,Z的原子序数为24.
原子序数小于36的X、Y、Z和铜四种元素,X的基态原子有3个不同的能级,有一个能级中的电子数比其它两个能级的中电子数都多1;Y基态原子中的电子占有5个轨道,其中有2个轨道处于半满状态,Z的原子序数为24.
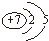 .
.