题目内容
5.常温下,下列说法正确的是( )| A. | 向Na2CO3溶液中加入等浓度等体积的盐酸:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | NaHS溶液中:c(OH-)+c(S2-)=c(H+)+c(H2S) | |
| C. | pH相同的①CH3COONa溶液、②NaClO溶液中c(Na+):①<② | |
| D. | pH=9的0.1mol•L-1的NaHR溶液中:c(HR-)>c(H+)>c(R2-)>c(H2R) |
分析 A.碳酸钠溶液中加入等浓度等体积的盐酸发生反应生成碳酸氢钠溶液和氯化钠溶液,结合物料守恒分析,n(Na)=n(C)+n(Cl);
B.溶液中存在电荷守恒c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-),根据物料守恒得c(Na+)=c(H2S)+c(HS-)+c(S2-),计算分析判断;
C.次氯酸根离子水解程度大于醋酸根离子,pH相同的①CH3COONa溶液、②NaClO溶液,溶液浓度①>②;
D.pH=9的0.1mol•L-1的NaHR溶液显碱性,说明HR-水解程度大于HR-电离程度.
解答 解:A.碳酸钠溶液中加入等浓度等体积的盐酸发生反应生成碳酸氢钠溶液和氯化钠溶液,结合物料守恒分析,n(Na)=n(C)+n(Cl),c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)+c(Cl-),故A错误;
B.溶液中存在电荷守恒c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-),根据物料守恒得c(Na+)=c(H2S)+c(HS-)+c(S2-),所以得c(S2-)+c(OH-)=c(H+)+c(H2S),故B正确;
C.次氯酸根离子水解程度大于醋酸根离子,pH相同的①CH3COONa溶液、②NaClO溶液,溶液浓度①>②,pH相同的①CH3COONa溶液、②NaClO溶液中c(Na+):①>②,故C错误;
D.pH=9的0.1mol•L-1的NaHR溶液显碱性,说明HR-水解程度大于HR-电离程度,溶液中:c(HR-)>c(H2R)>c(H+)>c(R2-),故D错误;
故选B.
点评 本题考查了电解质溶液中盐类水解、弱电解质电离平衡、电解质溶液中物料守恒、电荷守恒、物料守恒的分析应用,掌握基础是解题关键,题目难度中等.

| A. | 氧化铝、氧化铁均为两性氧化物 | |
| B. | 氧化铝中的微粒半径:r(Al3+)>r(O2-) | |
| C. | 在该反应中,铝的还原性强于铁的还原性 | |
| D. | 1mol 氧化铁参加反应转移电子数约为4×6.02×1023 |
CuSO4(s)=Cu2+(aq)+SO${\;}_{4}^{2-}$(aq)△H2<0.
若CuSO4•5H20受热分解的化学方程式为:CuSO4•5H2O(s)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4(s)+5H2O(l),热效应为△H3.则下列判断正确的是( )
| A. | △H1<△H3 | B. | △H2>△H3 | C. | △H1+△H3=△H2 | D. | △H1+△H2=△H3 |
①消去反应②取代反应③加成反应④水解反应.
| A. | ①② | B. | ①②③ | C. | ②③ | D. | ①②③④ |
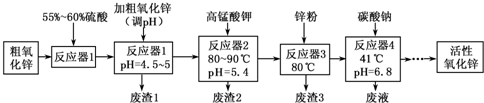
| Fe(OH)2 | Fe( OH)3 | Cu(OH)2 | Zn(OH)2 | Mn(OH)2 | |
| 开始沉淀的pH | 7.5 | 2.2 | 5.2 | 6.4 | 8.6 |
| 沉淀完全的pH | 9.0 | 3.2 | 6.7 | 8.0 | 10.1 |
(1)“废渣1”的主要成分是Fe( OH)3.
(2)完成“反应器2”中反应之一的离子方程式:□MnO-4+□Mn2++□2H2O=□MnO2↓+□H+
(3)蘸取“反应器2”中的溶液点在淀粉碘化钾试纸上,如果观察到试纸变蓝,说明KMnO4过量.
(4)“废渣2”分离出的MnO2可用于制取MnO,已知:
2MnO2(s)+C(s)═2MnO(s)+CO2(g)△H=-174.6kJ•mol-1
C(s)+CO2(g)═2CO(g)△H=+283.0kJ•mol-1
试写出MnO2(s)与CO(g)反应制取MnO(s)的热化学方程式:MnO2(s)+CO(g)=MnO(s)+CO2(g)△H=-228.8kJ/mol.
(5)“反应器3”中加入锌粉的作用是调节溶液pH,除去溶液中Cu2+.
(6)“反应器4”得到的废液中,含有的主要离子除了Na+外,还有K+、SO42-.
(7)从“反应器4”中经过滤等操作得到碱式碳酸锌.取碱式碳酸锌3.41g,在400~450℃下加热至恒重,得到ZnO 2.43g和标准状况下CO2 0.224L,碱式碳酸锌的化学式ZnCO3•2Zn(OH)2•H2O.

| A. | 拉瓦锡研究了空气的成分,让大家认识了氧气 | |
| B. | 图为雾霾的主要成分示意图,汽车尾气的大量排放是造成雾霾天气的人为因素之一 | |
| C. | “滴水石穿、绳锯木断、落汤螃蟹着红袍”均不包含化学变化 | |
| D. | “看似风平浪静,实则暗流涌动”形象地描述了溶解平衡的状态 |
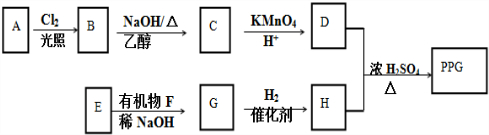
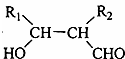
 .
. .
. .
.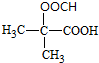 .
.
 (R1、R2代表烃基或氢原子)
(R1、R2代表烃基或氢原子) 某课外兴趣小组测定某未知浓度的NaOH溶液时,他们的测定过程大体如下:
某课外兴趣小组测定某未知浓度的NaOH溶液时,他们的测定过程大体如下: