题目内容
18.(1)X是短周期中原子半径最小的元素,X、Y组成的气体甲能使湿润的红色石蕊试纸变蓝;①Y的原子结构示意图是
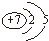 .
.②写出向硝酸铝溶液中通入过量气体甲的反应的离子方程式Al3++3NH3+3H2O═Al(OH)3↓+3NH4+.
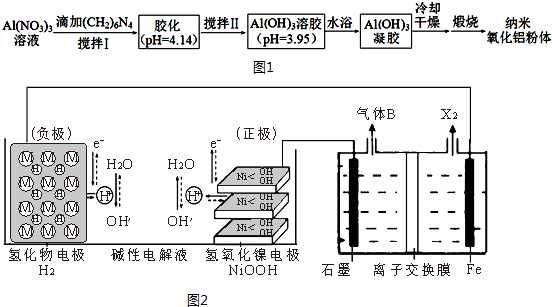
(2)用硝酸铝溶液(加入分散剂)制备纳米氧化铝粉体的一种工艺流程如图1.
已知:①(CH2)6N4水溶液显碱性.
②Ksp[Al(OH)3]=1.3×10-33;溶液中离子浓度小于1×10-5mol•L-1时,可认为这种离子在溶液中不存在
①凝胶中含有的硝酸盐除硝酸铝外还有硝酸铵.
②0.1mol•L-1上述硝酸盐溶液中,所含离子浓度由大到小的顺序是c(NO3-)>c(NH4+)>c(H+)>c(OH-).
(3)(图2)镍氢电池(NiMH)正极板材料为NiOOH,负极板材料为吸氢合金,该电池在充电过程中的总反应方程式是:Ni(OH)2+M═NiOOH+MH
①放电时负极反应为:H2-2e-+2OH-═2H2O;
②充电时阳极反应为:Ni(OH)2+OH--e-═NiOOH+H2O.
③利用镍氢电池电解50mL l.00mol/L食盐水,电解一段时间后,收集到标准状况下的X2气体1.12L(设电解后溶液体积不变).则电解后溶液的pH=14,阳极产生气体的体积在标准状况下是0.84L.
分析 (1)X是短周期中原子半径最小的元素,则X为H元素;X、Y组成的气体甲能使湿润的红色石蕊试纸变蓝,则Y为N元素,甲为NH3;
(2)硝酸铝加入(CH2)6N4水溶液充分搅拌,调节溶液pH=3.95时可生成氢氧化铝胶体,水浴加热生成氢氧化铝凝胶,冷却、干燥后煅烧可得纳米氧化铝.
①(CH2)6N4水溶液显碱性,-3价的N元素结合氢离子,+2价的CH2基团结合氢氧根离子,水解方程式为:(CH2)6N4+10H2O?6HCHO+4NH4++4OH-,溶液中会存在硝酸铵;
②硝酸铵溶液中NH4+离子水解,溶液呈酸性;
(3)充电过程中的总反应方程式是:Ni(OH)2+M═NiOOH+MH,属于电解过程.
①放电时过程属于原电池,放电过程总反应式为:NiOOH+MH=Ni(OH)2+M,负极发生氧化反应,氢气失去电子,碱性条件下生成水;
②充电时阳极发生氧化反应,Ni(OH)2失去电子生成NiOOH,由电荷守恒,有氢氧根离子参与反应,同时有水生成;
③石墨为阳极,Fe为阴极,X2气体为氢气,阴极只有氢离子放电,阳极首先是氯离子放电生成氯气,氯离子放电完毕,氢氧根离子放电生成氧气,氢气物质的量为0.05mol,氯化钠为0.05mol,NaCl不足,阳极有氧气生成,最终为NaOH溶液,根据钠离子守恒计算NaOH浓度,进而计算溶液pH;根据氯原子守恒计算氯气物质的量,根据电子转移守恒计算氧气物质的量,进而计算阳极得到气体体积.
解答 解:(1)X是短周期中原子半径最小的元素,则X为H元素;X、Y组成的气体甲能使湿润的红色石蕊试纸变蓝,则Y为N元素,甲为NH3.
①Y为N元素,原子结构示意图是: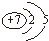 ,故答案为:
,故答案为: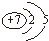 ;
;
②向硝酸铝溶液中通入过量氨气的反应的离子方程式:Al3++3NH3+3H2O═Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3+3H2O═Al(OH)3↓+3NH4+;
(2)硝酸铝加入(CH2)6N4水溶液充分搅拌,调节溶液pH=3.95时可生成氢氧化铝胶体,水浴加热生成氢氧化铝凝胶,冷却、干燥后煅烧可得纳米氧化铝.
①(CH2)6N4水溶液显碱性,-3价的N元素结合氢离子,+2价的CH2基团结合氢氧根离子,水解方程式为:(CH2)6N4+10H2O?6HCHO+4NH4++4OH-,溶液中会存在硝酸铵,
故答案为:硝酸铵;
②硝酸铵溶液中NH4+离子水解,溶液呈酸性,溶液中离子浓度大小为:c(NO3-)>c(NH4+)>c(H+)>c(OH-),
故答案为:c(NO3-)>c(NH4+)>c(H+)>c(OH-);
(3)充电过程中的总反应方程式是:Ni(OH)2+M═NiOOH+MH,属于电解过程.
①放电时过程属于原电池,放电过程总反应式为:NiOOH+MH=Ni(OH)2+M,负极发生氧化反应,氢气失去电子,碱性条件下生成水,负极电极反应式为:H2-2e-+2OH-═2H2O,
故答案为:H2-2e-+2OH-═2H2O;
②充电时阳极发生氧化反应,Ni(OH)2失去电子生成NiOOH,由电荷守恒,有氢氧根离子参与反应,同时有水生成,阳极电极反应式为:Ni(OH)2+OH--e-═NiOOH+H2O,
故答案为:Ni(OH)2+OH--e-═NiOOH+H2O;
③石墨为阳极,Fe为阴极,X2气体为氢气,阴极只有氢离子放电,阳极首先是氯离子放电生成氯气,氯离子放电完毕,氢氧根离子放电生成氧气,氢气物质的量为$\frac{1.12L}{22.4L/mol}$=0.05mol,转移电子为0.05mol×2=0.1mol,氯化钠为0.05L×1mol/L=0.05mol,氯离子完全放电转移电子为0.05mol,故NaCl不足,阳极有氧气生成,最终为NaOH溶液,根据钠离子守恒c(OH-)=c(NaOH)=c(NaCl)=1mol/L,故溶液中c(H+)=10-14mol/L,则溶液pH=-lg10-14=14,
生成氯气为$\frac{0.05mol}{2}$=0.025mol,根据电子转移守恒,生成氧气物质的量为$\frac{0.1mol-0.05mol}{4}$=0.0125mol,阳极产生的气体为Cl2和O2,总体积V=(0.025+0.0125)mol×22.4L/mol=0.84L,
故答案为:14;0.84.
点评 本题考查结构性质位置关系应用、盐类水解、原电池与电解原理等,属于拼合型题目,(2)中注意对水解反应的理解判断发生的反应,(3)中注意根据守恒法进行计算,是对学生综合能力的考查.

 阅读快车系列答案
阅读快车系列答案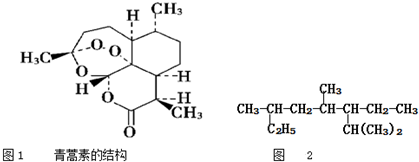
| A. | 下列物质的沸点按由低到高的顺序排列为CH3(CH2)2CH3<CH3(CH2)3CH3<(CH3)3CCH3<(CH3)2CHCH2CH3 | |
| B. | 青蒿素是抗疟疾特效药,结构如图1所示,有酯基、过氧键和醚键,不溶于水,易溶于氯仿、丙酮等,可以用乙醚从植物中提取,能够发生水解反应,具有强氧化性 | |
| C. | 油脂在一定条件下水解成高级脂肪酸和甘油,称为皂化反应 | |
| D. | 按系统命名法命名时,图2有机物的名称是3,5,7-三甲基-6-乙基辛烷 |
CuSO4(s)=Cu2+(aq)+SO${\;}_{4}^{2-}$(aq)△H2<0.
若CuSO4•5H20受热分解的化学方程式为:CuSO4•5H2O(s)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4(s)+5H2O(l),热效应为△H3.则下列判断正确的是( )
| A. | △H1<△H3 | B. | △H2>△H3 | C. | △H1+△H3=△H2 | D. | △H1+△H2=△H3 |
Ⅰ.CaCO3(s)?CO2(g)+CaO(s)△H=+178.2kJ/mol
Ⅱ.SO2(g)+CaO(s)?CaSO3(s)△H=-402kJ/mol
Ⅲ.2CaSO3(s)+O2(g)+4H2O(l)?2[CaSO4•2H2O](s)△H=-234.2kJ/mol
(1)试写出由石灰石、二氧化硫、氧气和水反应生成生石膏的热化学方程式2CaCO3(s)+O2(g)+2SO2(g)+4H2O(l)?2[CaSO4.2H2O](s)+2CO2(g)△H=-681.8kJ/mol.
(2)反应Ⅱ为烟气除硫的关键,取相同用量的反应物在3种不同的容器中进行该反应,A容器保持恒温恒压,B容器保持恒温恒容,C容器保持恒容绝热,且初始时3个容器的容积和温度均相同,下列说法正确的是ad
a.3个容器中SO2的转化率的大小顺序:aA>aB>aC
b.当A容器内气体的平均摩尔质量不变时,说明反应处于化学平衡状态
c.A、B两个容器达到平衡所用的时间:tA>tB
d.当C容器内平衡常数不变时,说明该反应处于化学平衡状态
(3)依据上述反应Ⅱ来除硫,将一定量的烟气压缩到一个20L的容器中,测得不同温度下,容器内SO2的质量(mg)如下表
 | 0 | 20 | 40 | 60 | 80 | 100 | 120 |
| T1 | 2100 | 1052 | 540 | 199 | 8.7 | 0.06 | 0.06 |
| T2 | 2100 | 869 | 242 | x | x | x | x |
②若其它条件都相同,则T1>T2(填“>”、“<”或“=”,下同);x<0.06.
③在T2温度下,若平衡后将容器的容积压缩为10L,则新平衡时SO2的浓度=原平衡时SO2的浓度(填“>”、“<”或“=”),理由是该反应的平衡常数表达式为k=$\frac{1}{c(S{O}_{2})}$,温度不变,平衡常数不变,所以浓度相等.
| Fe(OH)2 | Fe( OH)3 | Cu(OH)2 | Zn(OH)2 | Mn(OH)2 | |
| 开始沉淀的pH | 7.5 | 2.2 | 5.2 | 6.4 | 8.6 |
| 沉淀完全的pH | 9.0 | 3.2 | 6.7 | 8.0 | 10.1 |
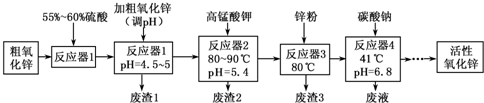
(1)“废渣1”的主要成分是Fe( OH)3.
(2)完成“反应器2”中反应之一的离子方程式:□MnO-4+□Mn2++□2H2O=□MnO2↓+□H+
(3)蘸取“反应器2”中的溶液点在淀粉碘化钾试纸上,如果观察到试纸变蓝,说明KMnO4过量.
(4)“废渣2”分离出的MnO2可用于制取MnO,已知:
2MnO2(s)+C(s)═2MnO(s)+CO2(g)△H=-174.6kJ•mol-1
C(s)+CO2(g)═2CO(g)△H=+283.0kJ•mol-1
试写出MnO2(s)与CO(g)反应制取MnO(s)的热化学方程式:MnO2(s)+CO(g)=MnO(s)+CO2(g)△H=-228.8kJ/mol.
(5)“反应器3”中加入锌粉的作用是调节溶液pH,除去溶液中Cu2+.
(6)“反应器4”得到的废液中,含有的主要离子除了Na+外,还有K+、SO42-.
(7)从“反应器4”中经过滤等操作得到碱式碳酸锌.取碱式碳酸锌3.41g,在400~450℃下加热至恒重,得到ZnO 2.43g和标准状况下CO2 0.224L,碱式碳酸锌的化学式ZnCO3•2Zn(OH)2•H2O.
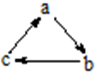 下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )| a | b | c | |
| A | Al | AlCl3 | Al(OH)3 |
| B | HCl | H2CO3 | HClO |
| C | Si | SiO2 | H2SiO3 |
| D | NaOH | NaHCO3 | Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
 某课外兴趣小组测定某未知浓度的NaOH溶液时,他们的测定过程大体如下:
某课外兴趣小组测定某未知浓度的NaOH溶液时,他们的测定过程大体如下: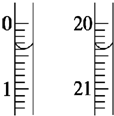 为测定Na2S2O3•5H2O产品纯度,准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000mol•L?1碘的标准溶液滴定. 反应原理为:2S2O32?+I2=S4O62-+2I?
为测定Na2S2O3•5H2O产品纯度,准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000mol•L?1碘的标准溶液滴定. 反应原理为:2S2O32?+I2=S4O62-+2I?