题目内容
某品牌糖衣片补血剂,除去糖衣后显淡蓝绿色,主要成分是硫酸亚铁,不含其它铁的化合物.某研究性学习小组为测定该补血剂中硫酸亚铁的含量进行了以下探究:

请回答下列问题:
Ⅰ.(1)实验时用18.4mol?L-1的浓硫酸,配制100mL 1mol?L-1 H2SO4溶液,所需浓硫酸的体积为 .(计算结果精确到小数点后一位)
(2)下列操作中,容量瓶所具备的功能有 (填序号).
A.配制一定体积准确浓度的标准溶液B.长期贮存溶液
C.用来溶解固体溶质 D.常用来代替量筒量取一定体积的液体
(3)在下列配制过程示意图中,有错误的是(填写序号) .

(4)下列说法正确的
A.洗涤烧杯2~3次,并将洗涤液移入容量瓶以减少误差
B.某同学将浓硫酸稀释后未冷却至室温便将溶液转移至容量瓶,所配溶液浓度会偏低
C.定容时仰视观察,所配溶液浓度会偏低
D.容量瓶使用前先要检查是否漏液,具体操作是向容量瓶中加蒸馏水,倒置不漏液即可
Ⅱ.(1)步骤②加入过量H2O2的目的: .
(2)从红褐色的悬浊液到最后的称量,其过程中所需的基本操作为:
a. ,b.洗涤,c.灼烧,d.冷却
(3)若称得固体的质量为ag,则每片补血剂中含硫酸亚铁的质量为 .
Ⅲ.已知人体不能很好地吸收利用Fe3+,科学研究表明服用含硫酸亚铁的补血剂时,同时服用维生素C,以利于铁元素的吸收.试分析维生素C在这一过程中的作用是 .

请回答下列问题:
Ⅰ.(1)实验时用18.4mol?L-1的浓硫酸,配制100mL 1mol?L-1 H2SO4溶液,所需浓硫酸的体积为
(2)下列操作中,容量瓶所具备的功能有
A.配制一定体积准确浓度的标准溶液B.长期贮存溶液
C.用来溶解固体溶质 D.常用来代替量筒量取一定体积的液体
(3)在下列配制过程示意图中,有错误的是(填写序号)

(4)下列说法正确的
A.洗涤烧杯2~3次,并将洗涤液移入容量瓶以减少误差
B.某同学将浓硫酸稀释后未冷却至室温便将溶液转移至容量瓶,所配溶液浓度会偏低
C.定容时仰视观察,所配溶液浓度会偏低
D.容量瓶使用前先要检查是否漏液,具体操作是向容量瓶中加蒸馏水,倒置不漏液即可
Ⅱ.(1)步骤②加入过量H2O2的目的:
(2)从红褐色的悬浊液到最后的称量,其过程中所需的基本操作为:
a.
(3)若称得固体的质量为ag,则每片补血剂中含硫酸亚铁的质量为
Ⅲ.已知人体不能很好地吸收利用Fe3+,科学研究表明服用含硫酸亚铁的补血剂时,同时服用维生素C,以利于铁元素的吸收.试分析维生素C在这一过程中的作用是
考点:配制一定物质的量浓度的溶液,探究物质的组成或测量物质的含量
专题:实验题
分析:Ⅰ.(1)根据浓硫酸在稀释前后,溶质的物质的量保持不变;(2)容量瓶是配制一定体积准确浓度的标准溶液的定容仪器;
(3)稀释浓硫酸时是将浓硫酸倒入水中,并用玻璃棒不断搅拌,使产生的热量迅速扩散;读数时应平视;
(4)根据公式c=
,可以根据影响n和V的因素来分析回答;
Ⅱ.由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.
(1)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,由流程图可知,加入H2O2是将Fe2+氧化为Fe3+;
(2)由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;
(3)根据铁元素守恒可知ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,据此计算;
Ⅲ.服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于人体吸收.
(3)稀释浓硫酸时是将浓硫酸倒入水中,并用玻璃棒不断搅拌,使产生的热量迅速扩散;读数时应平视;
(4)根据公式c=
| n |
| V |
Ⅱ.由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.
(1)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,由流程图可知,加入H2O2是将Fe2+氧化为Fe3+;
(2)由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;
(3)根据铁元素守恒可知ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,据此计算;
Ⅲ.服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于人体吸收.
解答:
解:Ⅰ.(1)浓硫酸在稀释前后,溶质的物质的量保持不变,设所需浓硫酸最小体积为V,则100mL×10-3×1mol/L=18.4mol/L×V,解得V=5.4mL,故答案为:5.4 ml;
(2)容量瓶作为精密仪器不可用于储存和溶解,也不能测量除其规格以外容积的液体体积,故答案为:A;
(3)稀释浓硫酸时是将浓硫酸沿器壁倒入水中,并用玻璃棒不断搅拌,使产生的热量迅速扩散;读数时应平视,不能仰视和俯视,故答案为:①④;
(4)A.洗涤烧杯2~3次,并将洗涤液移入容量瓶,否则浓度偏小,故A正确;
B.未冷却体积偏小,浓度偏大,故B错误;
C.定容时仰视,体积偏大,浓度偏小,故C正确;
D.在瓶中放水到标线附近,塞紧瓶塞,使其倒立2min,用干滤纸片沿瓶口缝处检查,看有无水珠渗出.如果不漏,再把塞子旋转180°,塞紧,倒置,试验这个方向有无渗漏,故D错误.
故答案为:AC;
Ⅱ.(1)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,故答案为:把亚铁离子全部氧化成铁离子;
(2)由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,故答案为:过滤;
(3)ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量
=0.07ag,含硫酸亚铁的质量为
=0.19ag,故答案为:0.19ag;
Ⅲ.维生素C有还原性,能服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于人体吸收,故答案为:作还原剂;防止Fe2+被氧化.
(2)容量瓶作为精密仪器不可用于储存和溶解,也不能测量除其规格以外容积的液体体积,故答案为:A;
(3)稀释浓硫酸时是将浓硫酸沿器壁倒入水中,并用玻璃棒不断搅拌,使产生的热量迅速扩散;读数时应平视,不能仰视和俯视,故答案为:①④;
(4)A.洗涤烧杯2~3次,并将洗涤液移入容量瓶,否则浓度偏小,故A正确;
B.未冷却体积偏小,浓度偏大,故B错误;
C.定容时仰视,体积偏大,浓度偏小,故C正确;
D.在瓶中放水到标线附近,塞紧瓶塞,使其倒立2min,用干滤纸片沿瓶口缝处检查,看有无水珠渗出.如果不漏,再把塞子旋转180°,塞紧,倒置,试验这个方向有无渗漏,故D错误.
故答案为:AC;
Ⅱ.(1)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,故答案为:把亚铁离子全部氧化成铁离子;
(2)由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,故答案为:过滤;
(3)ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量
ag×
| ||
| 10 |
| 0.07ag | ||
|
Ⅲ.维生素C有还原性,能服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于人体吸收,故答案为:作还原剂;防止Fe2+被氧化.
点评:本题考查学生对物质的量浓度溶液的配制实验原理与实验操作的理解、化学计算等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.

练习册系列答案
相关题目
设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A、1mol甲醛分子中含C-H键数目为2NA |
| B、常温常压下,7g乙烯分子的数目为0.5NA |
| C、25℃,pH=2的盐酸中含有H+的数目为0.01NA |
| D、标准状况下,2.24L氯气与1.12L液态水反应转移的电子数一定为0.1NA |
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g |
| B、53gNa2CO3固体含有的CO32-离子数为0.5 NA |
| C、室温下,21.0g乙烯和丁烯的混合气体中含有的共价键数目为3NA |
| D、5.6 g Fe和一定量的浓HNO3或稀HNO3完全反应,转移电子一定均为0.3NA |
NA表示阿佛加德罗常数,下列推断正确的是( )
| A、1mol Fe3+和28g的Si都含有NA个原子 |
| B、标况下,22.4 L的空气中含有NA个单质分子 |
| C、1mol Cl2参加反应时,转移的电子数可能是2NA个 |
| D、含有NA个Na的金属钠,投入1L H2O中,所得溶液的物质的量浓度为1 mol/l |
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、常温常压下,48gO3含有的原子数为3NA |
| B、1L 1mol/L 的CH3COOH溶液中含有的CH3COO-的数目为NA |
| C、11.2 L氧气所含的原子数为NA |
| D、5.6g铁与盐酸完全反应时失去的电子数为0.2NA |
化学是以实验为基础的自然科学,化学实验中的安全意识是重要的科学素养.下列实验操作或事故处理中正确的是( )
| A、稀释浓硫酸时,应将水沿器壁慢慢注入浓硫酸中,并不断搅拌 |
| B、蒸发溶液时有液体飞溅,应立即加水冷却 |
| C、将酒精灯熄灭后,再向其中补充酒精至适量 |
| D、金属钠、钾着火时,应立即用沙子或湿抹布扑灭 |
 如图是A~O的转化关系.已知A、F是金属单质,B、C、D、E、H、I、J、K常温常压下均为气体,且B、C、D、E是单质,I是一种红棕色气体,G是一种淡黄色固体,M的水溶液遇硫氰化钾溶液显红色,J与K相遇会产生大量白烟.请回答下列问题:
如图是A~O的转化关系.已知A、F是金属单质,B、C、D、E、H、I、J、K常温常压下均为气体,且B、C、D、E是单质,I是一种红棕色气体,G是一种淡黄色固体,M的水溶液遇硫氰化钾溶液显红色,J与K相遇会产生大量白烟.请回答下列问题: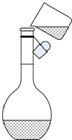 实验室中需要配制500mL0.10mol/L的NaOH溶液.回答下列问题.
实验室中需要配制500mL0.10mol/L的NaOH溶液.回答下列问题.