题目内容
18.某共价化合物含碳、氢、氮三种元素,分子内有四个氮原子,且四个氮原子构成正四面体(如白磷结构)每两个氮原子间都有一个碳原子.已知分子内无碳碳单键,也没有碳碳双键,则该化合物的分子式为( )| A. | C6H12N4 | B. | C4H8N4 | C. | C6H10N4 | D. | C6H8N4 |
分析 形成化合物时,碳可形成4个键,氢形成1个键,氮下形成三个键均是饱和的以及分子构型,以此可确定有机物的分子式.
解答 解:四个氮原子构成正四面体,正四面体有6条边,所以有6个C原子,因为N原子构成正四面体的四个顶点,与3个C原子成键,分子内无碳碳单键,也没有碳碳双键,每个C还有两个共价键可以和H原子结合,共要结合12个氢原子,即化合物的化学式是C6H12N4.
故选A.
点评 本题考查有机物的成键规律,侧重于学生的分析能力的考查,注意原子的成键数目是解题的关键,难度不大.

练习册系列答案
相关题目
9.下列说法正确的是( )
| A. | 除去苯甲酸中少量不溶性杂质和可溶性杂质,可采取分液的方法 | |
| B. | 乙炔、苯和乙苯的实验式相同 | |
| C. | 可用溴水鉴别乙醇、甲苯和溴苯 | |
| D. | 有机物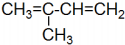 的系统命名为2-甲基-1,3-二丁烯 的系统命名为2-甲基-1,3-二丁烯 |
13.下列关于强、弱电解质的叙述正确的是?( )
| A. | 强酸、强碱及大部分盐类属于强电解质,弱酸、弱碱属于弱电解质 | |
| B. | 所有的离子化合物都是强电解质,所有的共价化合物都是弱电解质 | |
| C. | 强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 | |
| D. | SO2的水溶液能导电,所以SO2是电解质 |
3.下列说法正确的是( )
| A. | 向0.1 mol•L-1KNO3溶液中滴加稀盐酸使溶液的pH=5,此时混合液中c(K+)<c(NO3-) | |
| B. | 25℃时,0.1 mol•L-1氨水和0.05 mol•L-1氨水中c(OH-)之比是2:1 | |
| C. | 0.1 mol•L-1NH4Cl溶液中c(Cl-)=c(NH4+) | |
| D. | 向CH3COONa溶液中加入适量CH3COOH使混合液pH=7,此时溶液中c(Na+)=c(CH3COO-) |
10.将几滴KSCN(SCN-是“类卤离子”,与Br-、I-等性质相似)溶液加入到含有Fe3+的酸性溶液中,溶液变成红色.将该红色溶液分为两份:
①一份中加入适量KMnO4溶液,红色褪去;
②向另一份中通入SO2,红色也褪去.
以下推测肯定不正确的是( )
①一份中加入适量KMnO4溶液,红色褪去;
②向另一份中通入SO2,红色也褪去.
以下推测肯定不正确的是( )
| A. | ②中红色褪去的原因是SO2将SCN-还原 | |
| B. | ①中红色褪去的原因是KMnO4将SCN-氧化 | |
| C. | ②中红色褪去的原因是SO2将Fe3+还原成Fe2+ | |
| D. | SCN-在适当条件下可失去电子被氧化为(SCN)2 |
8.下列离子方程式书写正确的是( )
| A. | 硫酸亚铁加过氧化氢溶液:Fe2++H2O2+2H+═Fe3++4H2O | |
| B. | 将少量硝酸银溶液滴入氨水中:Ag++2NH3•H2O═[Ag(NH3)2]++2H2O | |
| C. | KAl(SO4)2中滴加Ba(OH)2使SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| D. | 铝粉与NaOH的溶液反应:2Al+2OH-═AlO2-+H2↑ |



 .
. .
.