题目内容
7.有机物F是一种重要的有机中间体,下图为由A制备F的反应过程:
已知:1,3-丁二烯能与具有双键的化合物进行1,4加成反应生成环状化合物,这类反应称为双烯合成,例如:

回答下列问题:
(1)在A→B的反应方程式中,A和B的物质的量之比是2:1.
(2)基本反应类型:B→C为加成反应;D→E氧化反应.
(3)D中所含官能团的名称为羟基、碳碳双键.
(4)E与足量的H2在镍的催化下反应的化学方程式是
 .
.(5)若F的其中一种同分异构体能与FeCl3溶液发生显色反应,且核磁共振氢谱上有4个峰,其面积之比为9:2:2:l,则该同分异构体的结构简式是
 .
.(6)写出以乙烯和l,3-丁二烯为原料,经3步合成l,2-环己二醇的流程图.
分析 由双烯合成反应信息,对比A、B的结构可知,2分子A发生加成反应得到B,对比B、C结构可知,过氧酸与B发生加成反应得到C,同时还是生成R-COOH,C与水发生开环的加成反应得到D,D发生氧化反应得到E,E脱去1分子水得到F.
(1)A→B是2分子A发生加成反应得到B;
(2)B→C属于加成反应,D→E属于氧化反应;
(3)由D的结构可知,D中含有的官能团为羟基、碳碳双键;
(4)E中羰基、醛基均能与氢气发生加成反应;
(5)若F的其中一种同分异构体能与FeCl3溶液发生显色反应,说明同分异构体中含有苯环与酚羟基,F的不饱和度为4,则取代基中没有不饱和键,且核磁共振氢谱上有4个峰,其面积之比为9:2:2:l,有9个H原子等效,含有三个甲基,侧链为-OH、-C(CH3)3且处于对位;
(6)1,3-丁二烯与乙烯发生加成反得到环己烯,环己烯与溴发生加成反应得到 ,最后在氢氧化钠水溶液、加热条件下发生水解反应得到l,2-环己二醇.
,最后在氢氧化钠水溶液、加热条件下发生水解反应得到l,2-环己二醇.
解答 解:由双烯合成反应信息,对比A、B的结构可知,2分子A发生加成反应得到B,对比B、C结构可知,过氧酸与B发生加成反应得到C,同时还是生成R-COOH,C与水发生开环的加成反应得到D,D发生氧化反应得到E,E脱去1分子水得到F.
(1)A→B是2分子A发生加成反应得到B,A和B的物质的量之比是2:1,
故答案为:2:1;
(2)B→C属于加成反应,D→E属于氧化反应,
故答案为:加成反应;氧化反应;
(3)由D的结构可知,D中含有的官能团为羟基、碳碳双键,
故答案为:羟基、碳碳双键;
(4)E中羰基、醛基均能与氢气发生加成反应,反应方程式为: ,
,
故答案为: ;
;
(5)若F的其中一种同分异构体能与FeCl3溶液发生显色反应,说明同分异构体中含有苯环与酚羟基,F的不饱和度为4,则取代基中没有不饱和键,且核磁共振氢谱上有4个峰,其面积之比为9:2:2:l,有9个H原子等效,含有三个甲基,侧链为-OH、-C(CH3)3且处于对位,该同分异构体的结构简式为: ,
,
故答案为: ;
;
(6)1,3-丁二烯与乙烯发生加成反得到环己烯,环己烯与溴发生加成反应得到 ,最后在氢氧化钠水溶液、加热条件下发生水解反应得到l,2-环己二醇,合成路线流程图为:
,最后在氢氧化钠水溶液、加热条件下发生水解反应得到l,2-环己二醇,合成路线流程图为: ,
,
故答案为: .
.
点评 本题考查有机物的合成、有机反应类型、官能团的结构与性质、限制条件同分异构体书写等,关键是理解双烯合成反应,侧重考查学生放学推理能力、知识迁移运用能力.

 阅读快车系列答案
阅读快车系列答案| A. | 14组 | B. | 20组 | C. | 26组 | D. | 32组 |
| A. | C6H12N4 | B. | C4H8N4 | C. | C6H10N4 | D. | C6H8N4 |
| A. | Ba(OH)2和 盐酸; Ba(OH)2 和 H2SO4 | |
| B. | BaCl2 和 Na2SO4; Ba(OH)2 和 (NH4)2SO4 | |
| C. | NaHCO3和 H2SO4; Ca(HCO3)2 和 HNO3 | |
| D. | Ba(OH)2 和 HNO3; Cu(OH)2 和 H2SO4 |
| A. | 放电时电解质溶液的密度减小 | B. | 放电时K+向Cd极区移动 | ||
| C. | 充电时阳极Cd元素被氧化 | D. | 充电时阴极附近的pH增大 |

相关资料:
①物质溶解度
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
外观性状:墨绿色结晶.其水溶液呈深绿色,这是锰酸根(MnO42-)的特征颜色.
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42-会发生歧化反应.
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚的理由是强碱腐蚀石英;
(2)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低.请写出实验中通入适量CO2时体系中可能发生反应离子方程式:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-,2OH-+CO2═CO32-+H2O(或3MnO42-+3CO2+2OH-═2MnO4-+MnO2↓+H2O+3CO32-);其中氧化还原反应中氧化剂和还原剂的质量比为1:2.
(3)由于CO2的通入量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸.从理论上分析,选用下列酸中A,得到的产品纯度更高.
A.醋酸 B.浓盐酸 C.稀硫酸
(4)工业上采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式2K2MnO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2KMnO4+H2↑+2KOH.
提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图2).
图2中A口加入的溶液最好为KOH溶液.使用阳离子交换膜可以提高Mn元素利用率的原因为阳离子交换膜防止锰酸根进入阴极区被还原.
(1)卤族元素位于元素周期表的P区;溴的价电子排布式为4S24P5.
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键.
(3)请根据表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是碘(写出名称).
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
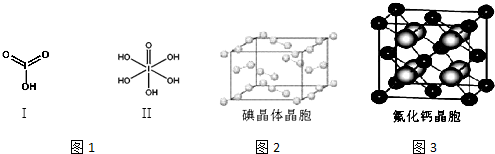
请比较二者酸性强弱:HIO3> H5IO6(填“>”、“<”或“=”).
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为sp3,写出一个ClO2-的等电子体Cl2O.
(6)图2为碘晶体晶胞结构.有关说法中正确的是AD.
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(见图3)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为$\frac{{a}^{3}ρ{N}_{A}}{4}$.
| A. | N2 | B. | NaOH | C. | H2O | D. | Ar |
| A. | 油脂皂化生成的高级脂肪酸钠是肥皂的有效成分 | |
| B. | 加热能杀死甲型 HINI 流感病毒是因为病毒的蛋白质受热变性 | |
| C. | 利用太阳能等能源替代化石能源能改善空气质量 | |
| D. | 人造纤维、合成纤维和光导纤维都是有机高分子化合物 |