题目内容
20.有关下图及实验的描述正确的是( )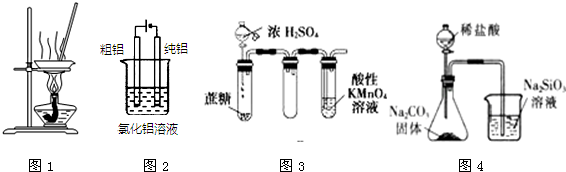
| A. | 用图1装置蒸发FeCl3溶液制备无水FeCl3 | |
| B. | 用图2装置精炼铝 | |
| C. | 用图3装置证明浓硫酸具有脱水性和强氧化性 | |
| D. | 用图4装置可比较氯、碳、硅三种元素的非金属性强弱 |
分析 A.氯化铁水解生成氢氧化铁和HCl,加热促进HCl挥发,蒸干时得到的固体是Fe(OH)3;
B.该装置中阳极上Al失电子生成铝离子,阴极上氢离子放电生成氢气,同时阴极附近生成OH-,铝离子在碱性条件下不能存在;
C.浓硫酸能将蔗糖中的H、O元素以2:1水的形式脱去而体现脱水性,能将有机物氧化为二氧化碳而体现强氧化性;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸.
解答 解:A.氯化铁水解生成氢氧化铁和HCl,加热促进HCl挥发,所以蒸干时得到的固体是Fe(OH)3而不是氯化铁,故A错误;
B.该装置中阳极上Al失电子生成铝离子,阴极上氢离子放电生成氢气,同时阴极附近生成OH-,铝离子在碱性条件下不能存在,生成氢氧化铝沉淀,所以阴极上得不到Al,故B错误;
C.浓硫酸能将蔗糖中的H、O元素以2:1水的形式脱去而体现脱水性,能将有机物氧化为二氧化碳而体现强氧化性,浓硫酸被蔗糖还原生成二氧化硫,二氧化硫能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,所以该实验能实现实验目的,故C正确;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸,HCl不是Cl元素的最高价氧化物的水化物,且生成的二氧化碳中含有挥发的HCl而影响碳酸和硅酸钠的反应,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及非金属性强弱判断、物质性质、电解原理、盐类水解等知识点,明确实验原理、物质性质是解本题关键,侧重考查学生分析判断能力,注意B中各个电极上发生的反应、D中HCl不是Cl元素的最高价氧化物的水化物,为易错点,题目难度中等.

练习册系列答案
相关题目
10.除去下列括号内杂质的试剂或方法错误的是( )
| A. | HNO3溶液(H2SO4),适量BaCl2溶液,过滤 | |
| B. | Fe2+(Fe3+),还原铁粉,过滤 | |
| C. | Cl2(HCl),饱和食盐水,洗气 | |
| D. | CO2(SO2),饱和NaHCO3溶液、浓硫酸,洗气 |
11.阿托酸是一种常用的医药中间体,其结构如图所示: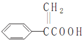 .下列有关说法中错误的是( )
.下列有关说法中错误的是( )
 .下列有关说法中错误的是( )
.下列有关说法中错误的是( )| A. | 溴单质能与阿托酸发生加成反应 | |
| B. | 阿托酸能与硝酸发生取代反应 | |
| C. | 可用酸性KMnO4溶液区别阿托酸与苯 | |
| D. | 阿托酸分子中含有4个碳双键 |
15.下列实验不能达到预期目的是( )
| A. | 用稀硫酸和锌粒反应制取氢气时加入少许硫酸铜粉末以加快反应速率 | |
| B. | 向乙酸乙酯中加入饱和碳酸钠溶液以除去乙酸乙酯中少量的乙酸 | |
| C. | 向盛有沸水的烧杯中滴加FeC13饱和溶液并长时间煮沸以制取Fe(OH)3胶体 | |
| D. | 向蔗糖中滴加浓硫酸可证明浓硫酸有脱水性 |
5.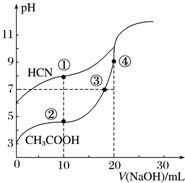 常温下,用0.10mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.10mol•L-1 CH3COOH溶液和HCN溶液所得滴定曲线如图.下列说法正确的是( )
常温下,用0.10mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.10mol•L-1 CH3COOH溶液和HCN溶液所得滴定曲线如图.下列说法正确的是( )
 常温下,用0.10mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.10mol•L-1 CH3COOH溶液和HCN溶液所得滴定曲线如图.下列说法正确的是( )
常温下,用0.10mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.10mol•L-1 CH3COOH溶液和HCN溶液所得滴定曲线如图.下列说法正确的是( )| A. | 点①和点②所示溶液中:c(CH3COO-)<c(CN-) | |
| B. | 点③和点④所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| C. | 点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) | |
| D. | 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH) |
12.胡妥油(D)用作香料的原料,它可由A合成得到:
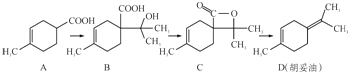
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 若有机物A是由异戊二烯(C5H8)和丙烯酸(C3H4O2)加热得到的,则该反应的反应类型属于加成反应 | |
| B. | 有机物B既能跟Na反应放出H2,又能跟NaHCO3溶液反应放出CO2气体 | |
| C. | 有机物C的所有同分异构体中不可能有芳香族化合物存在 | |
| D. | 有机物D能发生加成、取代、氧化、还原等反应 |
10.下列古诗中对应的化学物质及相关说法均正确的是( )
| 选项 | 诗句 | 相关物质 | 相关说法 |
| A | 春蚕到死丝方尽 | 纤维素 | 高分子化合物 |
| B | 蜡炬成灰泪始干 | 脂肪烃 | 不饱和烃 |
| C | 沧海月明珠有泪 | 碳酸钙 | 强电解质 |
| D | 蓝田日暖玉生烟 | 二氧化硅 | 两性氧化物 |
| A. | A | B. | B | C. | C | D. | D |