题目内容
10.除去下列括号内杂质的试剂或方法错误的是( )| A. | HNO3溶液(H2SO4),适量BaCl2溶液,过滤 | |
| B. | Fe2+(Fe3+),还原铁粉,过滤 | |
| C. | Cl2(HCl),饱和食盐水,洗气 | |
| D. | CO2(SO2),饱和NaHCO3溶液、浓硫酸,洗气 |
分析 A.硫酸与氯化钡反应生成沉淀和盐酸;
B.Fe与铁离子反应生成亚铁离子;
C.HCl极易溶于水,食盐水抑制氯气的溶解;
D.二氧化硫与碳酸氢钠反应生成二氧化碳.
解答 解:A.硫酸与氯化钡反应生成沉淀和盐酸,引入新杂质盐酸,不能除杂,故A错误;
B.Fe与铁离子反应生成亚铁离子,则还原铁粉,过滤可除杂,故B正确;
C.HCl极易溶于水,食盐水抑制氯气的溶解,则饱和食盐水,洗气可除杂,故C正确;
D.二氧化硫与碳酸氢钠反应生成二氧化碳,则饱和NaHCO3溶液、浓硫酸,洗气可除杂,故D正确;
故选A.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及发生的反应为解答的关键,侧重分析与应用能力的考查,注意除杂的原则及元素化合物知识,注重元素化合物与实验相结合的训练,题目难度不大.

练习册系列答案
相关题目
17.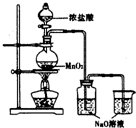 某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:
某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:
(1)写出利用上述装置制备消毒液涉及反应的化学方程式4HCl+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O、Cl2+2NaOH═NaClO+NaCl+H2O.
(2)盘阅资料:酚酞的变色范围为8.2~10,且酚酞在强碱性溶液中红色会褪去为探究操作a中溶液褪色的原因,又补充了如下实验:
获得结论:此实验小组制备的消毒液具有漂白性性.
(3)该小组由操作b获得结论:随着溶液酸性的增强,此消毒液的稳定性下降.
①操作b中溶液变成黄绿色的原因:2H++ClO-+Cl-═Cl2↑+H2O(用离子方程式表示).
②有人认为由操作b获得上述结论并不严谨.需要进一步确认此结论的实验方案是取洗气瓶中溶液5mL,向其中逐滴加入硫酸,观察溶液是否逐渐变为黄绿色.
(4)有效氯的含量是检测含氯消毒剂消毒效果的重要指标.具体用“单位质量的含氯消 毒液在酸性条件下所能释放出氯气的质量”进行表征.一般家用消毒液有效氯含量在5%以上.小组同学进行如下实验测定有效氯:取此消毒液5g,加入20mL0.5mol•L-1KI溶液,10mL2mol•L-1的硫酸溶液;加几滴淀粉溶液后.用0.1mol•L-1Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O320mL.(已知:2S2O32-+I2═S4O62-+2I-)
①达到滴定终点时的实验现象是溶液蓝色褪去且半分钟恢复.
②此消毒液有效氯含量为1.42%.
 某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:
某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:| 操作 | 现象 |
| a.测溶液pH,并向其中滴加2滴酚酞 | pH=3,溶液变红,5min后褪色 |
| b.向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
(2)盘阅资料:酚酞的变色范围为8.2~10,且酚酞在强碱性溶液中红色会褪去为探究操作a中溶液褪色的原因,又补充了如下实验:
| 操作 | 现象 |
| 取5mL pH=13NaOH溶液,向其中滴加2滴酚酞 | 溶液变红,30min后褪色 |
(3)该小组由操作b获得结论:随着溶液酸性的增强,此消毒液的稳定性下降.
①操作b中溶液变成黄绿色的原因:2H++ClO-+Cl-═Cl2↑+H2O(用离子方程式表示).
②有人认为由操作b获得上述结论并不严谨.需要进一步确认此结论的实验方案是取洗气瓶中溶液5mL,向其中逐滴加入硫酸,观察溶液是否逐渐变为黄绿色.
(4)有效氯的含量是检测含氯消毒剂消毒效果的重要指标.具体用“单位质量的含氯消 毒液在酸性条件下所能释放出氯气的质量”进行表征.一般家用消毒液有效氯含量在5%以上.小组同学进行如下实验测定有效氯:取此消毒液5g,加入20mL0.5mol•L-1KI溶液,10mL2mol•L-1的硫酸溶液;加几滴淀粉溶液后.用0.1mol•L-1Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O320mL.(已知:2S2O32-+I2═S4O62-+2I-)
①达到滴定终点时的实验现象是溶液蓝色褪去且半分钟恢复.
②此消毒液有效氯含量为1.42%.
18.如表为元素周期表的一部分,X、Y、Z、W为短周期元素,其中X元素的原子最外层电子数是其内层电子数的2倍,下列说法正确的是( )
| X | Y | ||
| Z | W | ||
| T |
| A. | 根据元素周期律,可以推测存在T3Y4、TZ2和TW4 | |
| B. | X氢化物的沸点一定比Y氢化物的沸点低 | |
| C. | XZ2、XW4与YW3都是非极性分子 | |
| D. | W的氧化物的水化物酸性一定比Z的强 |
15.在国际环境问题中,一次性使用聚苯乙烯材料带来的“白色污染”极为严重.这种材料难分解,处理麻烦.最近研制出了一种新材料: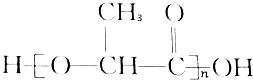 能代替聚苯乙烯,它是由乳酸缩聚而成,能在乳酸菌的作用下降解而消除对环境的污染.下列关于聚乳酸的说法正确的是( )
能代替聚苯乙烯,它是由乳酸缩聚而成,能在乳酸菌的作用下降解而消除对环境的污染.下列关于聚乳酸的说法正确的是( )
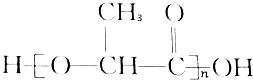 能代替聚苯乙烯,它是由乳酸缩聚而成,能在乳酸菌的作用下降解而消除对环境的污染.下列关于聚乳酸的说法正确的是( )
能代替聚苯乙烯,它是由乳酸缩聚而成,能在乳酸菌的作用下降解而消除对环境的污染.下列关于聚乳酸的说法正确的是( )| A. | 聚乳酸是一种纯净物 | B. | 聚乳酸的单体是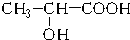 | ||
| C. | 聚乳酸是一种羧酸 | D. | 其聚合方式和乙烯相同 |
5.《化学反应原理》一书中,我们学习了两个重要的定量实验.请回答下列问题:
Ⅰ、某化学兴趣小组要完成中和热的测定.
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、5mol?L-1 盐酸、0.55mol?L-1NaOH溶液,尚缺少的实验玻璃用品是量筒、温度计.
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?否(填“能”或“否”),其原因是金属易导热,热量散失导致误差大.
(3)他们记录的实验数据如下:
已知:Q(放)=C m(t2-t1),反应后溶液的比热容C为4.18KJ?℃-1?Kg-1,m指溶液的质量,各物质的密度均为1g?cm-3.
①计算分析△H=-56.8KJ/mol.(结果保留3位有效数字)
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-56.8KJ/mol.
Ⅱ、为了测定含有H2C2O4•2H2O、KHC2O4和K2SO4的试样中各物质的质量分数,进行如下实验:
①称取6.0g试样,加水溶解,配成250mL试样溶液.
②用酸式滴定管量取25.00mL试样溶液放入锥形瓶中,并加入2~3滴酚酞试液,用0.2500mol/L NaOH溶液滴定,消耗NaOH溶液20.00mL.
③再取25.00mL试样溶液放入另一锥形瓶中,用0.1000mol/L的酸性高锰酸钾溶液滴定,消耗高锰酸钾溶液16.00mL.
回答下列问题:
(1)已知:0.10mol/L KHC2O4溶液pH约为3,其中含碳元素的粒子浓度由大到小的顺序为c(HC2O4-)>c(C2O42-)>c(H2C2O4).
(2)完成并配平下列离子方程式
5C2O42-+2MnO4-+16H+=10CO2+2Mn2++8H2O.
(3)步骤②中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则测得的H2C2O4•2H2O的质量分数偏小.(填“偏大”、“偏小”或“无影响”)
(4)步骤③中判断滴定终点的方法是滴入最后一滴溶液呈紫红色且半分钟颜色不变.
(5)常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示:
(i)写出H2C2O4的电离方程式H2C2O4?H++HC2O4-,HC2O4-?H++C2O42-.
(ii)KHC2O4溶液显酸性的原因是 (请用方程式并结合必要的文字回答该小题)HC2O4-?H++C2O42-,HC2O4-+H2O?H2C2O4+OH-,但其电离程度大于水解程.
(iii)向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是ad.
a.c(K+)═c(HC2O4-)+c(H2C2O4)+c(C2O42- ) b.c(Na+)═c(H2C2O4)+c(C2O42-)
c.c(K+)+c(Na+)═c(HC2O4-)+c(C2O42- ) d.c(K+)>c(Na+)
Ⅰ、某化学兴趣小组要完成中和热的测定.
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、5mol?L-1 盐酸、0.55mol?L-1NaOH溶液,尚缺少的实验玻璃用品是量筒、温度计.
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?否(填“能”或“否”),其原因是金属易导热,热量散失导致误差大.
(3)他们记录的实验数据如下:
| 实 验 试剂如下: | 溶 液 温 度 | 中和热△H | ||||
| t1 | t2 | |||||
| ① | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.3℃ | ||
| ② | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.5℃ | ||
①计算分析△H=-56.8KJ/mol.(结果保留3位有效数字)
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-56.8KJ/mol.
Ⅱ、为了测定含有H2C2O4•2H2O、KHC2O4和K2SO4的试样中各物质的质量分数,进行如下实验:
①称取6.0g试样,加水溶解,配成250mL试样溶液.
②用酸式滴定管量取25.00mL试样溶液放入锥形瓶中,并加入2~3滴酚酞试液,用0.2500mol/L NaOH溶液滴定,消耗NaOH溶液20.00mL.
③再取25.00mL试样溶液放入另一锥形瓶中,用0.1000mol/L的酸性高锰酸钾溶液滴定,消耗高锰酸钾溶液16.00mL.
回答下列问题:
(1)已知:0.10mol/L KHC2O4溶液pH约为3,其中含碳元素的粒子浓度由大到小的顺序为c(HC2O4-)>c(C2O42-)>c(H2C2O4).
(2)完成并配平下列离子方程式
5C2O42-+2MnO4-+16H+=10CO2+2Mn2++8H2O.
(3)步骤②中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则测得的H2C2O4•2H2O的质量分数偏小.(填“偏大”、“偏小”或“无影响”)
(4)步骤③中判断滴定终点的方法是滴入最后一滴溶液呈紫红色且半分钟颜色不变.
(5)常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示:
| H2C2O4 | KHC2O4 | K2C2O4 | |
| pH | 2.1 | 3.1 | 8.1 |
(ii)KHC2O4溶液显酸性的原因是 (请用方程式并结合必要的文字回答该小题)HC2O4-?H++C2O42-,HC2O4-+H2O?H2C2O4+OH-,但其电离程度大于水解程.
(iii)向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是ad.
a.c(K+)═c(HC2O4-)+c(H2C2O4)+c(C2O42- ) b.c(Na+)═c(H2C2O4)+c(C2O42-)
c.c(K+)+c(Na+)═c(HC2O4-)+c(C2O42- ) d.c(K+)>c(Na+)
2.要除去氯化亚铁溶液中的少量氯化铁,可行的办法是( )
| A. | 滴入KSCN溶液 | B. | 通入氯气 | C. | 滴入NaOH溶液 | D. | 加入铁粉 |
19.化学与生活、生产密切相关,下列说法错误的是( )
| A. | 大力防治 PM2.5 的污染防治,可减少雾霾天气 | |
| B. | “84 消毒液”具有强氧化性,可作环境的消毒剂 | |
| C. | 发展低碳经济,利用太阳能、风能实现城市照明 | |
| D. | 可以用福尔马林溶液保存海鲜产品 |
20.有关下图及实验的描述正确的是( )
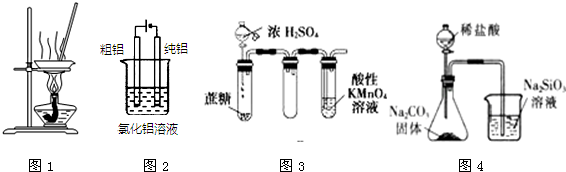

| A. | 用图1装置蒸发FeCl3溶液制备无水FeCl3 | |
| B. | 用图2装置精炼铝 | |
| C. | 用图3装置证明浓硫酸具有脱水性和强氧化性 | |
| D. | 用图4装置可比较氯、碳、硅三种元素的非金属性强弱 |
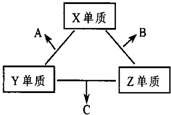 X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图变化:
X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图变化: