题目内容
17.(1)某课外活动小组同学用图1装置(M、N为外电源的两个电极)进行实验,试回答下列问题:
①若开始时开关K与a连接,则铁发生电化学腐蚀中的吸氧腐蚀.请写出正极反应式:O2+4e-+2H2O=4OH-.
②若开始时开关K与b连接时,两极均有气体产生,则铁电极为阴极(填“阴”或“阳”),该电极上发生的电极反应式为2H++2e-═H2↑,总反应的离子方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)该小组同学设想,用如图2所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠.
①B出口导出的气体是O2,制得的氢氧化钠溶液从出口D(填“A”、“B”、“C”或“D”)导出.通过阴离子交换膜的离子数<(填“>”、“<”或“=”)通过阳离子交换膜的离子数.
②氢气、氧气和氢氧化钠溶液又可制成燃料电池,该电池的负极反应式为H2+2OH--2e-=2H2O.
分析 (1)①开始时开关K与a连接形成原电池反应,发生吸氧腐蚀,B电极铁做负极失电子生成亚铁离子,A电极石墨做正极溶液中氧气得到电子生成氢氧根离子;
②开始时开关K与b连接形成电解池,与电源正极相连的A电极为阳极,溶液中氯离子失电子生成氯气,与电源负极相连的B电极为电解池的阴极,溶液中氢离子得到电子生成氢气,电解氯化钠溶液生成氢氧化钠、氢气和氯气;
(2)①阳极氢氧根离子失电子生成氧气;阴极上氢离子放电,则NaOH在阴极生成;根据阴阳离子的移动方向,通过相同电量时,阴阳离子交换的个数判断;
②氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,负极上氢气失去电子.
解答 解:(1)①开始时开关K与a连接形成原电池反应,发生吸氧腐蚀,A电极石墨做正极溶液中氧气得到电子生成氢氧根离子,电极反应为:O2+2H2O+4e-=4OH-,
故答案为:吸氧;O2+2H2O+4e-=4OH-;
②开关K与b连接,装置为电解池,铁为阴极,发生还原反应,氢离子得到电子生成氢气,即B电极反应为2H++2e-=H2↑;电解饱和食盐水生成氢氧化钠、氢气和氯气,电解总反应的离子方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑,
故答案为:2H++2e-═H2↑;2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑;
(2)①阳极氢氧根离子失电子生成氧气,则B出口导出的气体是O2;阴极上氢离子放电,则NaOH在阴极生成,由图可知,D在阴极附近,制得的氢氧化钠溶液从D出口导出;阳极氢氧根离子放电,因此硫酸根离子向阳极移动,阴极氢离子放电,因此钠离子向阴极移动,所以通过相同电量时,通过阴离子交换膜的离子数小于通过阳离子交换膜的离子数,
故答案为:O2;D;<;
②氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,负极上氢气失去电子生成水,负极反应式为H2-2e-+2OH-=2H2O,
故答案为:H2-2e-+2OH-=2H2O.
点评 本题考查了原电池和电解池原理,注意装置的判断及原电池电极反应式和电解反应的书写,把握电解质溶液的酸碱性确定生成的离子或物质,题目难度中等,侧重于考查学生的分析能力.

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
根据实验结果,下列判断正确的是( )
| A. | Fe2+、I-、Cl-三种离子一定存在 | |
| B. | 不能确定Na+和Cl-是否存在,CO${\;}_{3}^{2-}$一定不存在 | |
| C. | Fe3+与Fe2+至少有一种 | |
| D. | 该溶液中c(Cl-)≥0.1mol•L-1 |
| ① | ② | ③ | ||
| ④ | ⑤ | ⑥ | ⑦ |
(2)⑤⑥⑦号元素的最高价氧化物的水化物中,酸性最强的是HClO4(填化学式).画出⑥⑦号元素形成的简单离子的结构示意图:
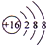 、
、 ,这两种离子的半径大小顺序是S2->Cl-(填化学式).
,这两种离子的半径大小顺序是S2->Cl-(填化学式).(3)②③⑥号元素的氢化物中,沸点最高的是H2O(填化学式);
(4)③④⑥号元素中,原子半径最大的是④(填序号).
(一)高炉炼铁过程中发生的主要反应为:
$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数 如下:
| 温度/℃ | 1000 | 1115 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
(2)欲提高上述反应中CO的平衡转化率,可采取的措施是B.
A.提高反应温度B.移出部分CO2
C.加入合适的催化剂D.减小容器的容积
(3)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时υ正>υ逆(填“>”、“<”或“=”).经过10min,在1000℃达到平衡,则该时间范围内反应的平均反应速率υ(CO2)=0.008mol/(L•min).
(二)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.
(4)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,其中反应的氧化剂是KClO;生成1mol K2FeO4转移电子的物质的量是3mol.
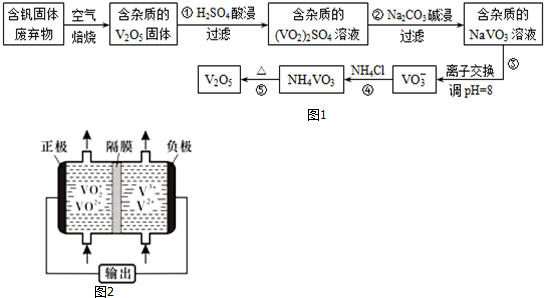
部分含钒化合物在水中的溶解性如下表:
| 物质 | V2O5 | NH4VO3 | VOSO4 | (VO2)2SO4 |
| 溶解性 | 难溶 | 难溶 | 可溶 | 易溶 |
(1)反应①所得溶液中除H+之外的阳离子有VO2+和Al3+.
(2)反应②碱浸后滤出的固体主要成分是Al(OH)3(写化学式).
(3)反应④的离子方程式为VO3-+NH4+=NH4VO3↓.
(4)25℃、101 kPa时,4Al(s)+3O2(g)═2Al2O3(s)△H1=-a kJ/mol
4V(s)+5O2(g)═2V2O5(s)△H2=-b kJ/mol
用V2O5发生铝热反应冶炼金属钒的热化学方程式是10Al(s)+3V2O5(s)=5Al2O3(s)+6V(s)△H=-$\frac{5a-3b}{2}$kJ/mol.
(5)钒液流电池(如图2所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过.电池放电时负极的电极反应式为V2+-e-=V3+,电池充电时阳极的电极反应式是VO2+-e-+H2O=VO2++2H+.
(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2VO2++H2C2O4+2H+═2VO2++2CO2↑+2H2O.取25.00mL 0.1000 mol/L
H2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0mL,由此可知,该(VO2)2SO4溶液中钒的含量为10.6g/L.
 |  |  |  |
| A.接近称量质量时,轻振手腕,加够药品 | B.溶解时,用量筒控制所加蒸馏水的量 | C.移液时,玻璃棒插在刻度线以上,防止液体洒出 | D.接近刻度线1~2 cm时,用胶头滴管滴加蒸馏水至刻度线 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 所需仪器有:100mL容量瓶、烧杯、玻璃棒、胶头滴管、托盘天平 | |
| B. | 将量取的浓盐酸先倒入容量瓶,再加入蒸馏水至刻度线,摇匀 | |
| C. | 将溶液转移入容量瓶,要用玻璃棒引流 | |
| D. | 定容时仰视刻度,所配溶液浓度偏小 |
| A. | 某气体$\stackrel{通入品红溶液中}{→}$品红溶液褪色 结论:某气体一定是SO2 | |
| B. | 某气体$\stackrel{通入澄清石灰水}{→}$ 产生白色沉淀 结论:某气体一定是CO2 | |
| C. | 某溶液$\stackrel{打开瓶盖}{→}$冒白雾$\stackrel{将沾有浓氨水的玻璃棒靠近}{→}$ 白烟 结论:原溶液一定是浓盐酸 | |
| D. | 某溶液$\stackrel{滴加KSCN溶液液}{→}$ 血红色溶液 结论:原溶液中一定含有Fe3+ |
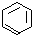 、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填物质编号),HCHO分子的立体构型为平面三角形.
、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填物质编号),HCHO分子的立体构型为平面三角形.