题目内容
12.由乙烷和乙醇蒸气组成的混和气体中,若碳元素的质量百分含量为60%,则氧元素的质量百分含量为( )| A. | 15% | B. | 21% | C. | 25% | D. | 无法确定 |
分析 乙烷的分子式为C2H6,乙醇的分子式为C2H6O,分子中C、H个数比为1:3,可计算二者的质量之比,根据碳元素的质量百分含量可计算出H的质量分数,进而计算氧元素的质量百分含量.
解答 解:乙烷的分子式为C2H6,乙醇的分子式为C2H6O,分子中C、H个数比为1:3,则二者的质量之比为12:3=4:1,
若碳元素的质量百分含量为60%,则H的质量分数为60%×$\frac{1}{4}$=15%,
所以O的质量分数为1-60%-15%=25%.
故选C.
点评 本题考查元素质量分数的计算,为高频考点,侧重考查学生的分析能力和计算能力,题目难度不大,注意把握分子的组成规律.

练习册系列答案
相关题目
2.在一恒温、恒容的密闭容器中发生反应A(s)+2B(g)?C(g)+D(g),当下列物理量不再变化时,能够表明该反应已达平衡状态的是( )
| A. | 混合气体的压强 | B. | D的物质的量浓度 | ||
| C. | A的物质的量浓度 | D. | 气体的总物质的量 |
3.下列溶液中氯离子浓度与50mL 1mol/L氯化铝溶液中氯离子浓度相等的是( )
| A. | 150mL1mol/L的氯化钠溶液 | B. | 75mL2mol/L的氯化铵溶液 | ||
| C. | 150mL3mol/L的氯化钾溶液 | D. | 75mL1mol/L的氯化亚铁溶液 |
20.某元素原子的核外M层电子数是4,该原子核内的质子数是( )
| A. | 14 | B. | 15 | C. | 16 | D. | 17 |
7.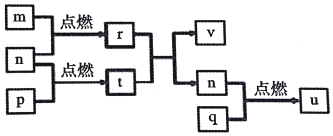 短周期主族元素X、Y、Z、W的原子序数依次增大.四种元素形成的单质依次为m、n、p、q,r、t、u是这些元素组成的二元化合物,其中u为形成酸雨的主要物质之一;25℃时,0.01mol•L-1的v溶液中:$\frac{c(O{H}^{-})}{c({H}^{+})}$=1.0×1010.上述物质的转化关系如图所示.下列说法正确的是( )
短周期主族元素X、Y、Z、W的原子序数依次增大.四种元素形成的单质依次为m、n、p、q,r、t、u是这些元素组成的二元化合物,其中u为形成酸雨的主要物质之一;25℃时,0.01mol•L-1的v溶液中:$\frac{c(O{H}^{-})}{c({H}^{+})}$=1.0×1010.上述物质的转化关系如图所示.下列说法正确的是( )
 短周期主族元素X、Y、Z、W的原子序数依次增大.四种元素形成的单质依次为m、n、p、q,r、t、u是这些元素组成的二元化合物,其中u为形成酸雨的主要物质之一;25℃时,0.01mol•L-1的v溶液中:$\frac{c(O{H}^{-})}{c({H}^{+})}$=1.0×1010.上述物质的转化关系如图所示.下列说法正确的是( )
短周期主族元素X、Y、Z、W的原子序数依次增大.四种元素形成的单质依次为m、n、p、q,r、t、u是这些元素组成的二元化合物,其中u为形成酸雨的主要物质之一;25℃时,0.01mol•L-1的v溶液中:$\frac{c(O{H}^{-})}{c({H}^{+})}$=1.0×1010.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径的大小:W>Z>Y>X | |
| B. | Z分别与Y、W组成的化合物中化学键类型可能相同 | |
| C. | v能抑制水的电离而u能促进水的电离 | |
| D. | 粘有q的试管可用酒精洗涤 |
17.实验室中需要配制2mol/L的NaCl溶液480mL,配制时应选用的容量瓶的规格和称取的NaCl的质量分别是( )
| A. | 480mL 56.2g | B. | 500mL 58.5g | ||
| C. | 1000mL 58.5g | D. | 任意规格 56.2g |
14.已知在25°C时,Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5.0×10-13,将AgC1与AgBr的饱和溶液等体积混合,现象为①,再加入足量浓AgNO3溶液,发生的反应为②,则下列选项中符合上述事实的是( )
| ① | ② | |
| A | 无明显现象 | 只有AgBr沉淀生成 |
| B | 生成淡黄色沉淀 | AgCl和AgBr沉淀都有,但AgCl沉淀更多 |
| C | 无明显现象 | AgCl和AgBr沉淀都有,但AgCl沉淀更多 |
| D | 生成黄色沉淀 | AgCl和AgBr沉淀都有,但AgBr沉淀更多 |
| A. | A | B. | B | C. | C | D. | D |
15.亚氯酸钠也是一种高效氧化剂、漂白剂,且能用作砂糖、食品生产的消毒剂,亚氯酸钠受热易分解,易溶于水.
(1)图1是生产亚氯酸钠的工艺流程图:

①写出Ⅱ的化学方程式ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
②操作Ⅰ包含C、E、过滤、洗涤
A.蒸发浓缩 B.蒸馏 C.减压蒸发浓缩 D.加热蒸发 E.冷却结晶 F.分液
(2)上述离子隔膜电解池的原理如图2,c、d为电极,ef、gh为离子交换膜,两膜中间的Na+和SO42-可通过隔膜,而两端隔室中离子被阻挡不能进入中间的隔室.
①c电极可以为B;
A.铁电极 B.石墨电极 C.铁或者石墨均可
②ef膜为阴离子交换膜(填“阳”或“阴”);
(3)亚氯酸钠漂白织物时真正起作用的是HClO2,表是25℃几种酸的电离平衡常数:
用亚氯酸钠漂白织物时,下列物质可以用作酸化剂的是c.
a.SO2 b.CO2 c.稀硫酸 d.盐酸 e.HClO.
(1)图1是生产亚氯酸钠的工艺流程图:

①写出Ⅱ的化学方程式ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
②操作Ⅰ包含C、E、过滤、洗涤
A.蒸发浓缩 B.蒸馏 C.减压蒸发浓缩 D.加热蒸发 E.冷却结晶 F.分液
(2)上述离子隔膜电解池的原理如图2,c、d为电极,ef、gh为离子交换膜,两膜中间的Na+和SO42-可通过隔膜,而两端隔室中离子被阻挡不能进入中间的隔室.
①c电极可以为B;
A.铁电极 B.石墨电极 C.铁或者石墨均可
②ef膜为阴离子交换膜(填“阳”或“阴”);
(3)亚氯酸钠漂白织物时真正起作用的是HClO2,表是25℃几种酸的电离平衡常数:
| 酸 | HClO2 | H2CO3 | HClO |
| Ka | 1×10-2 | K1=4.3×10-7、K2=5.6×10-11 | 3×10-8 |
a.SO2 b.CO2 c.稀硫酸 d.盐酸 e.HClO.
 如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉).请回答:
如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉).请回答: