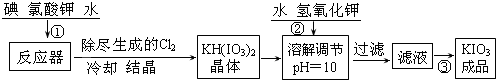
题目内容
在含有15gNaI的溶液中,通入一定量的Cl2后,将溶液小心蒸干得固体9.51g,则参加反应的NaI的质量为 .
考点:化学方程式的有关计算
专题:计算题
分析:发生反应2NaI+Cl2=I2+2NaCl,利用固体质量差,根据差量法计算参加反应的碘化钠的物质的量,根据m=nM计算参加反应NaI的质量.
解答:
解:反应后固体质量减小为15g-9.51g=5.49g,
2 NaI+Cl2=I2+2NaCl 固体质量差△m
2mol 254g-71g=183g
n(NaI) 5.49g
故n(NaI)=2mol×
=0.06mol,
参加反应NaI的质量为0.06mol×150g/mol=9.0g,
故答案为:9.0g.
2 NaI+Cl2=I2+2NaCl 固体质量差△m
2mol 254g-71g=183g
n(NaI) 5.49g
故n(NaI)=2mol×
| 5.49g |
| 183g |
参加反应NaI的质量为0.06mol×150g/mol=9.0g,
故答案为:9.0g.
点评:本题考查根据方程式进行的计算,难度不大,注意利用差量法进行的计算.

练习册系列答案
相关题目
不用其他试剂,只用试管和胶头滴管无法鉴别的溶液是( )
| A、Al2(SO4)3和氨水 |
| B、Na2CO3和稀盐酸 |
| C、NaCl和AgNO3 |
| D、盐酸和NaAlO2 |
 铜合金及铜的氯化物在生产生活中有着广泛的应用.请回答下列问题:
铜合金及铜的氯化物在生产生活中有着广泛的应用.请回答下列问题: