题目内容
加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解.工业生产碘酸钾的流程如图:
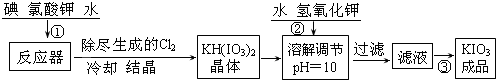
(1)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应.用四氯化碳检验所生成的碘时,主要用到的玻璃仪器有 .
(2)从滤液中得到KIO3成品的操作为 ,操作时除不断用玻璃棒搅拌外,还需要注意的事项有 .
(3)某探究学习小组测定加碘食盐中碘的含量,设计的实验步骤如下:
①准确称取w g食盐,加适量蒸馏水使其完全溶解;
②用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;反应的方程式如下,请配平:
KIO3+ KI+ H2SO4═ K2SO4+ I2+ H2O;
③生成的碘单质用Na2S2O3溶液滴定,反应的离子方程式为:I2+2S2O32-═2I-+S4O62-.滴定时,选择 为指示剂,眼睛应该注视 ,达到滴定终点时的现象为 ,加入物质的量浓度为2.0×10-3mol?L-1的Na2S2O3溶液10.0mL时,恰好反应完全.
(4)该加碘食盐样品中的碘元素含量是 mg/kg(以含w的代数式表示).

(1)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应.用四氯化碳检验所生成的碘时,主要用到的玻璃仪器有
(2)从滤液中得到KIO3成品的操作为
(3)某探究学习小组测定加碘食盐中碘的含量,设计的实验步骤如下:
①准确称取w g食盐,加适量蒸馏水使其完全溶解;
②用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;反应的方程式如下,请配平:
③生成的碘单质用Na2S2O3溶液滴定,反应的离子方程式为:I2+2S2O32-═2I-+S4O62-.滴定时,选择
(4)该加碘食盐样品中的碘元素含量是
考点:探究物质的组成或测量物质的含量,氧化还原反应方程式的配平
专题:实验题,氧化还原反应专题
分析:(1)根据实验操作可知,用四氯化碳检验碘时,需要用到萃取,则需要用到分液漏斗;
(2)由KIO3溶液得到KIO3成品,则需要蒸发结晶;根据蒸发结晶所需要的注意事项判断;
(3)②反应中I2→KH(IO3)2,I元素化合价由0价升高为+5价,共升高10价.KClO3→KCl、Cl2,氯元素化合价降低,还原产物为KCl、Cl2,KClO3→KCl氯元素化合价由+5降低为-1价,化合价降低6价,KClO3→Cl2氯元素化合价由+5降低为0价,化合价总共降低10价,二者获得的电子数目相同,获得电子最小公倍数为30,则KCl的系数为5,Cl2的系数为3,所以化合价降低60价,故I2系数为6,根据元素守恒配平KClO3、H2O、KH(IO3)2的系数;
③根据反应的离子方程式可知,第②步生成的碘单质被消耗,则可选用与碘单质显色的淀粉做指示剂;根据滴定操作注意事项回答;
(4)根据硫代硫酸钠与碘酸钾的关系式计算碘酸钾的物质的量,再根据质量分数公式计算碘的含量.
(2)由KIO3溶液得到KIO3成品,则需要蒸发结晶;根据蒸发结晶所需要的注意事项判断;
(3)②反应中I2→KH(IO3)2,I元素化合价由0价升高为+5价,共升高10价.KClO3→KCl、Cl2,氯元素化合价降低,还原产物为KCl、Cl2,KClO3→KCl氯元素化合价由+5降低为-1价,化合价降低6价,KClO3→Cl2氯元素化合价由+5降低为0价,化合价总共降低10价,二者获得的电子数目相同,获得电子最小公倍数为30,则KCl的系数为5,Cl2的系数为3,所以化合价降低60价,故I2系数为6,根据元素守恒配平KClO3、H2O、KH(IO3)2的系数;
③根据反应的离子方程式可知,第②步生成的碘单质被消耗,则可选用与碘单质显色的淀粉做指示剂;根据滴定操作注意事项回答;
(4)根据硫代硫酸钠与碘酸钾的关系式计算碘酸钾的物质的量,再根据质量分数公式计算碘的含量.
解答:
解:(1)(1)根据实验操作可知,用四氯化碳检验碘时,需要用到萃取,则需要用到分液漏斗,故答案为:分液漏斗;
(2)由KIO3溶液得到KIO3成品,则需要将溶剂蒸发掉,而得到晶体,该操作为蒸发结晶;当蒸发到较多晶体析出时,溶剂较少,为了防止形成的晶体KIO3受热分解,应停止加热,用仪器的余热蒸干溶剂,故答案为:蒸发结晶;当析出较多晶体时,应停止加热,利用余热蒸干;
(3)②反应中I2→KH(IO3)2,I元素化合价由0价升高为+5价,共升高10价.KClO3→KCl、Cl2,氯元素化合价降低,还原产物为KCl、Cl2,KClO3→KCl氯元素化合价由+5降低为-1价,化合价降低6价,KClO3→Cl2氯元素化合价由+5降低为0价,化合价总共降低10价,二者获得的电子数目相同,获得电子最小公倍数为30,则KCl的系数为5,Cl2的系数为3,所以化合价降低60价,故I2系数为6,根据元素守恒配平KClO3、H2O、KH(IO3)2的系数,化学方程式可写为:1 KIO3+5 KI+3 H2SO4═3 K2SO4+3 I2+3 H2O,故答案为:1、5、3、3、3、3;
③根据反应的离子方程式可知,第②步生成的碘单质被消耗,则可选用与碘单质显色的淀粉做指示剂;滴定时,眼睛应时刻注视溶液颜色变化,防止滴定过量;滴定终点时,为了防止出现滴定不足或者滴定过量,应保持溶液半分钟内颜色不变,故答案为:
淀粉; 锥形瓶内溶液颜色的变化;当滴入最后一滴时,溶液蓝色刚好消失,且30秒内不恢复;
(4)设碘酸钾的物质的量为x.
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O①; I2+2S2O32-=2I-+S4O62-②,将方程式②×3+①得
IO3-+6H++6S2O32-=I-+3S4O62-+3H2O
1 6
x 2.0×10-3mol/L×0.01L
x=
=
×10-5mol,根据碘原子守恒知,碘元素的质量=
×10-5mol/L×127g/mol=
×10-5g,所以碘元素的质量分数=
×100%=
mg/kg,故答案为:
.
(2)由KIO3溶液得到KIO3成品,则需要将溶剂蒸发掉,而得到晶体,该操作为蒸发结晶;当蒸发到较多晶体析出时,溶剂较少,为了防止形成的晶体KIO3受热分解,应停止加热,用仪器的余热蒸干溶剂,故答案为:蒸发结晶;当析出较多晶体时,应停止加热,利用余热蒸干;
(3)②反应中I2→KH(IO3)2,I元素化合价由0价升高为+5价,共升高10价.KClO3→KCl、Cl2,氯元素化合价降低,还原产物为KCl、Cl2,KClO3→KCl氯元素化合价由+5降低为-1价,化合价降低6价,KClO3→Cl2氯元素化合价由+5降低为0价,化合价总共降低10价,二者获得的电子数目相同,获得电子最小公倍数为30,则KCl的系数为5,Cl2的系数为3,所以化合价降低60价,故I2系数为6,根据元素守恒配平KClO3、H2O、KH(IO3)2的系数,化学方程式可写为:1 KIO3+5 KI+3 H2SO4═3 K2SO4+3 I2+3 H2O,故答案为:1、5、3、3、3、3;
③根据反应的离子方程式可知,第②步生成的碘单质被消耗,则可选用与碘单质显色的淀粉做指示剂;滴定时,眼睛应时刻注视溶液颜色变化,防止滴定过量;滴定终点时,为了防止出现滴定不足或者滴定过量,应保持溶液半分钟内颜色不变,故答案为:
淀粉; 锥形瓶内溶液颜色的变化;当滴入最后一滴时,溶液蓝色刚好消失,且30秒内不恢复;
(4)设碘酸钾的物质的量为x.
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O①; I2+2S2O32-=2I-+S4O62-②,将方程式②×3+①得
IO3-+6H++6S2O32-=I-+3S4O62-+3H2O
1 6
x 2.0×10-3mol/L×0.01L
x=
| 2.0×10-3mol/L×0.01L |
| 6 |
| 1 |
| 3 |
| 1 |
| 3 |
| 127 |
| 3 |
| ||
| w |
| 1270 |
| 3w |
| 1270 |
| 3w |
点评:考查物质组成与含量的测定、对实验原理理解、氧化还原滴定、阅读获取信息的能力等,难度较大,是对知识的综合运用,理解实验原理是解题的关键,需要学生具有扎实的基础与综合运用分析解决问题的能力.

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
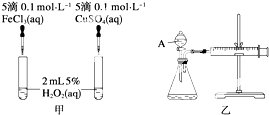 为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是( )
为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是( )| A、图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小 |
| B、若图甲所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好 |
| C、用图乙所示装置测定反应速率,可测定反应产生的气体体积及反应时间 |
| D、为检查图乙所示装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位 |
把3.0mol M和2.5mol N混合于2.0L的恒容密闭容器中,发生反应3M(g)+N(g)?xP(g)+2Q(g),5min反应达到平衡,已知M的转化率为50%,P的反应速率为0.15mol?L-1?min-1,则下列说法正确的是( )
| A、方程式中x=2 |
| B、达平衡后,容器内压强是反应起始时的2倍 |
| C、向容器中再充入3.0 mol M和2.5 mol N,达新平衡时Q的体积分数减小 |
| D、容器内混合气体的密度不再变化和平均相对分子质量不再变化均可作为达到平衡状态的标志 |
 (1)NaClO溶液在碱性条件下将CN-氧化成无毒的碳酸根离子和N2,该反应离子方程式
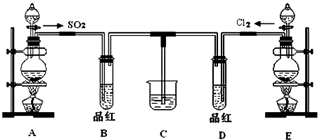
(1)NaClO溶液在碱性条件下将CN-氧化成无毒的碳酸根离子和N2,该反应离子方程式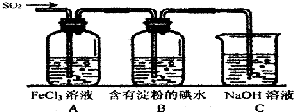 某兴趣小组探究SO2气体的性质,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体的性质,他们使用的药品和装置如图所示: