题目内容
 铜合金及铜的氯化物在生产生活中有着广泛的应用.请回答下列问题:
铜合金及铜的氯化物在生产生活中有着广泛的应用.请回答下列问题:(1)向硫酸铜、氯化钠混合溶液中滴加亚硫酸钠溶液生成CuCl沉淀,
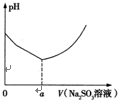
实验测得溶液的pH与亚硫酸钠溶液体积的关系曲线如图所示.
①用离子方程式解释亚硫酸钠溶液呈碱性的原因:
②用离子方程式解释图象中V<a时溶液酸性增强的原因:
当V>a时,随着亚硫酸钠溶液的体积增大,溶液pH增大的原因是
(2)已知:Ksp(AgCl)=8×10-10,Ksp(CuCl)=1.2×10-6.向CuCl 浊液中滴加硝酸银溶液,
发生反应CuCl(s)+Ag+(aq)═AgCl(s)+Cu+(aq),该应平衡常数K=
(3)硫酸铜溶液中含少量硫酸铁,加入氢氧化铜,过滤,除去三价铁离子,写出加入氢氧化铜时发生反应的离子方程式:
(4)测定CuCl和CuCl2混合物中CuCl含量的原理为用氯化铁溶液溶解样品,以邻菲罗啉作指示剂,用Ce(SO4)2溶液滴定至终点,滴定反应为Ce4++Fe3+=Fe2++Ce3+.氯化铁与氯化亚铜反应的离子方程式为
考点:铜金属及其重要化合物的主要性质,离子方程式的书写,难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:(1)①根据盐类水解方程式进行书写;
②结合反应方程式的产物进行判断,硫酸铜、氯化钠和亚硫酸钠反应生成氯化亚铜和硫酸、氯化钠;随着亚硫酸钠溶液的体积增大,因为亚硫酸钠溶液呈碱性,所以消耗了溶液中的氢离子;
(2)根据平衡常数的表达式进行计算;
(3)根据沉淀转换书写,铁离子和氢氧化铜反应生成氢氧化铁和铜离子;
(4)氯化铁与氯化亚铜反应生成氯化亚铁和氯化铜.
②结合反应方程式的产物进行判断,硫酸铜、氯化钠和亚硫酸钠反应生成氯化亚铜和硫酸、氯化钠;随着亚硫酸钠溶液的体积增大,因为亚硫酸钠溶液呈碱性,所以消耗了溶液中的氢离子;
(2)根据平衡常数的表达式进行计算;
(3)根据沉淀转换书写,铁离子和氢氧化铜反应生成氢氧化铁和铜离子;
(4)氯化铁与氯化亚铜反应生成氯化亚铁和氯化铜.
解答:
解:(1)①亚硫酸钠溶液呈碱性的原因是亚硫酸根水解生成亚硫酸氢根和氢氧根,离子方程式为:SO32-+H2O?HSO3-+OH-,故答案为:SO32-+H2O?HSO3-+OH-;
②硫酸铜、氯化钠和亚硫酸钠反应生成氯化亚铜和硫酸、氯化钠,离子方程式为:2Cu2++2Cl-+SO32-+H2O═2CuCl↓+SO42-+2H+;随着亚硫酸钠溶液的体积增大,因为亚硫酸钠溶液呈碱性,所以消耗了溶液中的氢离子,溶液pH增大,
故答案为:2Cu2++2Cl-+SO32-+H2O═2CuCl↓+SO42-+2H+;亚硫酸钠消耗了溶液中H+;
(2)由CuCl(s)+Ag+(aq)═AgCl(s)+Cu+(aq),得K=
=
=
=
=1.5×103;故答案为:1.5×103;
(3)铁离子和氢氧化铜反应生成氢氧化铁和铜离子,离子方程式为:2Fe3++3Cu(OH)2═2Fe(OH)3↓+3Cu2+,故答案为:2Fe3++3Cu(OH)2═2Fe(OH)3↓+3Cu2+;
(4)氯化铁与氯化亚铜反应生成氯化亚铁和氯化铜,离子方程式为:Fe3++CuCl═Fe2++Cu2++Cl-,故答案为:Fe3++CuCl═Fe2++Cu2++Cl-.
②硫酸铜、氯化钠和亚硫酸钠反应生成氯化亚铜和硫酸、氯化钠,离子方程式为:2Cu2++2Cl-+SO32-+H2O═2CuCl↓+SO42-+2H+;随着亚硫酸钠溶液的体积增大,因为亚硫酸钠溶液呈碱性,所以消耗了溶液中的氢离子,溶液pH增大,
故答案为:2Cu2++2Cl-+SO32-+H2O═2CuCl↓+SO42-+2H+;亚硫酸钠消耗了溶液中H+;
(2)由CuCl(s)+Ag+(aq)═AgCl(s)+Cu+(aq),得K=
| C(Cu+) |
| C(Ag+) |
| ||
|
| Ksp(CuCl) |
| Ksp(AgCl) |
| 1.2×10 -6 |
| 8×10 -10 |
(3)铁离子和氢氧化铜反应生成氢氧化铁和铜离子,离子方程式为:2Fe3++3Cu(OH)2═2Fe(OH)3↓+3Cu2+,故答案为:2Fe3++3Cu(OH)2═2Fe(OH)3↓+3Cu2+;
(4)氯化铁与氯化亚铜反应生成氯化亚铁和氯化铜,离子方程式为:Fe3++CuCl═Fe2++Cu2++Cl-,故答案为:Fe3++CuCl═Fe2++Cu2++Cl-.
点评:本题主要考查了氯化亚铜的制备原理及其平衡常数的计算,关键是方程式的书写,抓住氧化还原反应书写的特征来写,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列表示物质结构的化学用语或模型图正确的是( )
| A、二氧化碳的结构式:O-C-O |
| B、H2O2的电子式:H+[:O:O:]2-H+ |
C、甲烷的比例模型: |
D、14C的原子结构示意图: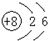 |
下列各组物质,不能由组成它的两种元素单质直接化合得到的是( )
| A、FeS |
| B、CuS |
| C、Fe3O4 |
| D、Al2S3 |
下列关于物质分离的实验说法正确的是( )
| A、用过滤的方法得到食盐水中的NaCl |
| B、用蒸发的方法从碳酸钙的悬浊液总提取碳酸钙 |
| C、用蒸发的方法得到海水中的水 |
| D、对医用酒精进行蒸馏操作可以得到更高纯度的酒精溶液 |
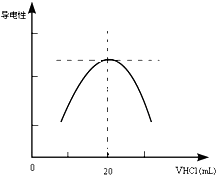 某学习小组甲利用中和反应原理和DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点.请回答:
某学习小组甲利用中和反应原理和DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点.请回答:

 (1)NaClO溶液在碱性条件下将CN-氧化成无毒的碳酸根离子和N2,该反应离子方程式
(1)NaClO溶液在碱性条件下将CN-氧化成无毒的碳酸根离子和N2,该反应离子方程式