题目内容
小明在做“研究温度对反应速率的影响”实验时,他取了两只试管,均加入4mL0.01mol/L的KMnO4酸性溶液和2mL0.1mol/LH2C2O4(乙二酸)溶液,振荡,A试管置于热水中,B试管置于凉水中,记录溶液褪色所需的时间.
①需要用 来酸化KMnO4溶液,褪色所需时间tA tB(填“>”、“=”或“<”).
②写出该反应的离子方程式 .
①需要用
②写出该反应的离子方程式
考点:探究影响化学反应速率的因素
专题:化学反应速率专题
分析:①高锰酸钾具有强氧化性,要酸化高锰酸钾溶液需要选用无还原性的酸,温度越高反应速率越快,则褪色时间越短;
②酸性条件下,高锰酸根离子能氧化草酸生成二氧化碳,自身被还原生成锰离子,同时生成水.
②酸性条件下,高锰酸根离子能氧化草酸生成二氧化碳,自身被还原生成锰离子,同时生成水.
解答:
解:(1)①高锰酸钾具有强氧化性,要酸化高锰酸钾溶液需要选用无还原性的酸,一般选稀硫酸,温度越高反应速率越快,则褪色时间越短,所以褪色所需时间tA<tB,故答案为:硫酸;<;
②酸性条件下,高锰酸根离子能氧化草酸生成二氧化碳,自身被还原生成锰离子,同时生成水,发生的离子反应方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O,
故答案为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
②酸性条件下,高锰酸根离子能氧化草酸生成二氧化碳,自身被还原生成锰离子,同时生成水,发生的离子反应方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O,
故答案为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
点评:本题考查温度对反应速率的影响的实验,难度较大.

练习册系列答案
相关题目
下列无机含氧酸酸性最弱的是( )
| A、HClO |
| B、H3PO4 |
| C、HNO3 |
| D、HClO4 |
下列表示物质结构的化学用语或模型图正确的是( )
| A、二氧化碳的结构式:O-C-O |
| B、H2O2的电子式:H+[:O:O:]2-H+ |
C、甲烷的比例模型: |
D、14C的原子结构示意图: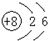 |
过程与离子反应方程式相匹配的是( )
| A、制备乙酸乙酯时将产生的蒸气导入饱和碳酸钠溶液:CO32ˉ+2H+=CO2↑+H2O | ||||
B、用石墨作电极电解氯化镁:2Cl-+2H2O
| ||||
| C、向亚硫酸钠溶液中滴加少量的新制氯水:2SO32ˉ+Cl2+2H2O=2SO42ˉ+2Clˉ+4H+ | ||||
| D、利用氯酸钾和浓盐酸制消毒剂ClO2:2ClO3ˉ+4H++2Clˉ=2ClO2↑+Cl2↑+2 H2O |
下列生活常见现象中,没有涉及化学变化的是( )
A、 光合作用 |
B、 炭烧取暖 |
C、 风力发电 |
D、 电解冶炼 |
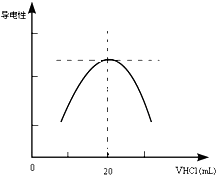 某学习小组甲利用中和反应原理和DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点.请回答:
某学习小组甲利用中和反应原理和DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点.请回答: