题目内容
某兴趣小组同学进行乙醛的银镜反应,实验操作步骤如下:
A.在试管里先注入少量NaOH溶液,振荡,然后加热煮沸.把NaOH溶液倒去后,再用蒸馏水洗净试管备用. B.在洗净的试管里配制银氨溶液.C.沿试管壁加入乙醛稀溶液.
D.加热.请回答下列问题:
(1)步骤A中加NaOH溶液振荡,加热煮沸的目的是: .
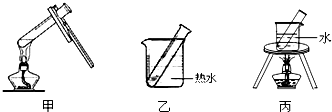
(2)步骤D应选择的加热方法是 (填下列装置编号),理由是 .
(3)乙醛发生银镜反应的化学方程式为: .
(4)该兴趣小组的同学还对乙醛进行银镜反应的最佳实验条件进行了探究(部分实验数据如下表):
①实验1和实验2,探究的是 .
②当银氨溶液的量为1mL,乙醛的量为3滴,温度为55℃,反应混合液pH为11时,出现银镜的时间为 min.(填范围)
③你认为探究乙醛进行银镜反应的最佳条件,除了测定银镜出现的时间外,还需要比较不同条件下形成的银镜的 .
(5)银氨溶液放久后会产生氮化银而引起爆炸,直接排放会污染环境,且造成银资源的浪费.实验室从反应后的废液中(含过量的银氨溶液,假设不含银)回收银的实验流程如下:

已知:[Ag(NH3)2]+在溶液中存在平衡:[Ag(NH3)2]+?Ag++2NH3.
①写出废液与稀HNO3反应的离子方程式 .
②加入的铁粉要过量的目的是: .
A.在试管里先注入少量NaOH溶液,振荡,然后加热煮沸.把NaOH溶液倒去后,再用蒸馏水洗净试管备用. B.在洗净的试管里配制银氨溶液.C.沿试管壁加入乙醛稀溶液.
D.加热.请回答下列问题:
(1)步骤A中加NaOH溶液振荡,加热煮沸的目的是:
(2)步骤D应选择的加热方法是

(3)乙醛发生银镜反应的化学方程式为:
(4)该兴趣小组的同学还对乙醛进行银镜反应的最佳实验条件进行了探究(部分实验数据如下表):
| 实验变量 实验序号 | 银氨溶液的量/mL | 乙醛的量/滴 | 温度/℃ | 反应混合液的pH | 出现银镜的时间/min |
| 1 | 1 | 3 | 65 | 11 | 5 |
| 2 | 1 | 3 | 45 | 11 | 6.5 |
| 3 | 1 | 5 | 65 | 11 | 4 |
②当银氨溶液的量为1mL,乙醛的量为3滴,温度为55℃,反应混合液pH为11时,出现银镜的时间为
③你认为探究乙醛进行银镜反应的最佳条件,除了测定银镜出现的时间外,还需要比较不同条件下形成的银镜的
(5)银氨溶液放久后会产生氮化银而引起爆炸,直接排放会污染环境,且造成银资源的浪费.实验室从反应后的废液中(含过量的银氨溶液,假设不含银)回收银的实验流程如下:

已知:[Ag(NH3)2]+在溶液中存在平衡:[Ag(NH3)2]+?Ag++2NH3.
①写出废液与稀HNO3反应的离子方程式
②加入的铁粉要过量的目的是:
考点:性质实验方案的设计
专题:实验设计题
分析:(1)欲使银镜反应实验成功必须用NaOH溶液煮沸试管以除去油污,以免析出的银难以附着在试管上;
(2)根据影响银镜产生的效果角度分析,为了受热均匀,采用热水浴加热;
(3)银镜反应的方程式书写,只有-CHO和2molAg(NH3)2OH反应,配平方法:1mol-CHO和2molAg(NH3)2OH反应;
(4)①对比实验1和实验2,反应条件只有温度不同,故其实验目的是:比较温度不同对银镜反应的影响;
②其它条件相同,随着温度升高,反应速率加快:其它条件相同,温度为55℃的反应速率应该在温度为45℃温度为65℃之间;
③银镜的光亮程度与反应条件有关;
(5)①银氨溶液的成分为Ag(NH3)2OH,在水中全部电离,电离出:[Ag(NH3)2]+和OH-,当加入稀硝酸时,H+会与氨气和氢氧根离子反应,故与稀硝酸反应的离子方程式为:[Ag(NH3)2]++OH-+3H+=Ag++2NH4++H2O;
②铁比银活泼,故加入的铁粉可以把Ag+从其溶液中还原,加过量的铁粉可以将溶液中的Ag+全部还原,加入铁粉要过量的目的是使溶液中的Ag+全部还原.
(2)根据影响银镜产生的效果角度分析,为了受热均匀,采用热水浴加热;
(3)银镜反应的方程式书写,只有-CHO和2molAg(NH3)2OH反应,配平方法:1mol-CHO和2molAg(NH3)2OH反应;
(4)①对比实验1和实验2,反应条件只有温度不同,故其实验目的是:比较温度不同对银镜反应的影响;
②其它条件相同,随着温度升高,反应速率加快:其它条件相同,温度为55℃的反应速率应该在温度为45℃温度为65℃之间;
③银镜的光亮程度与反应条件有关;
(5)①银氨溶液的成分为Ag(NH3)2OH,在水中全部电离,电离出:[Ag(NH3)2]+和OH-,当加入稀硝酸时,H+会与氨气和氢氧根离子反应,故与稀硝酸反应的离子方程式为:[Ag(NH3)2]++OH-+3H+=Ag++2NH4++H2O;
②铁比银活泼,故加入的铁粉可以把Ag+从其溶液中还原,加过量的铁粉可以将溶液中的Ag+全部还原,加入铁粉要过量的目的是使溶液中的Ag+全部还原.
解答:
解:(1)欲使银镜反应实验成功必须用NaOH溶液煮沸试管以除去油污,若试管不洁净析出的银难以附着在试管上;
故答案为:除去试管内壁的油污,保证试管洁净;
(2)加热时试管抖动或试管中液体沸腾都将影响银镜产生的效果,为了受热均匀,采用热水浴加热,装置乙符合要求,
故答案为:乙;
(3)银镜反应的方程式书写,只有-CHO和2molAg(NH3)2OH反应,其它结构不变;配平方法:1mol-CHO和2molAg(NH3)2OH反应,反应的方程式为CH3CHO+2Ag(NH3)2OH
CH3COONH4+2Ag↓+3NH3+H2O,
故答案为:CH3CHO+2Ag(NH3)2OH
CH3COONH4+2Ag↓+3NH3+H2O;
(4)①对比实验1和实验2的反应条件,其它条件相同,只有温度不同,其实验目的是比较银镜反应中,温度不同对生成银镜的影响;
故答案为:温度对反应速率的影响;
②由实验1和实验2知:银氨溶液的量为1mL,乙醛的量为3滴,反应混合液pH为11时,水浴温度为45℃,出现银镜时间为6.5min,水浴温度为65℃,出现银镜时间为5min,其它条件相同,随着温度升高,反应速率加快,故:当银氨溶液的量为1mL,乙醛的量为3滴,水浴温度为55℃,反应混合液pH为11时,出现银镜的时间应在5min到6.5min之间,
故答案为:5~6.5;
③银镜反应实验如果条件控制适当,析出的银会均匀地分布在试管壁上,形成光亮的银镜,银镜的光亮程度与反应条件有关;
故答案为:光亮程度;
(5)①银氨溶液的成分为Ag(NH3)2OH,在水中全部电离,电离出:[Ag(NH3)2]+和OH-,当加入稀硝酸时,H+会与氨气和氢氧根离子反应,故与稀硝酸反应的离子方程式为:[Ag(NH3)2]++OH-+3H+=Ag++2NH4++H2O;
故答案为:[Ag(NH3)2]++OH-+3H+=Ag++2NH4++H2O;
②铁比银活泼,故加入的铁粉可以把Ag+从其溶液中还原,加过量的铁粉可以将溶液中的Ag+全部还原,加入铁粉要过量的目的是使溶液中的Ag+反应完全;
故答案为:使溶液中的Ag+全部还原.
故答案为:除去试管内壁的油污,保证试管洁净;
(2)加热时试管抖动或试管中液体沸腾都将影响银镜产生的效果,为了受热均匀,采用热水浴加热,装置乙符合要求,
故答案为:乙;
(3)银镜反应的方程式书写,只有-CHO和2molAg(NH3)2OH反应,其它结构不变;配平方法:1mol-CHO和2molAg(NH3)2OH反应,反应的方程式为CH3CHO+2Ag(NH3)2OH
| △ |
故答案为:CH3CHO+2Ag(NH3)2OH
| △ |
(4)①对比实验1和实验2的反应条件,其它条件相同,只有温度不同,其实验目的是比较银镜反应中,温度不同对生成银镜的影响;
故答案为:温度对反应速率的影响;
②由实验1和实验2知:银氨溶液的量为1mL,乙醛的量为3滴,反应混合液pH为11时,水浴温度为45℃,出现银镜时间为6.5min,水浴温度为65℃,出现银镜时间为5min,其它条件相同,随着温度升高,反应速率加快,故:当银氨溶液的量为1mL,乙醛的量为3滴,水浴温度为55℃,反应混合液pH为11时,出现银镜的时间应在5min到6.5min之间,
故答案为:5~6.5;
③银镜反应实验如果条件控制适当,析出的银会均匀地分布在试管壁上,形成光亮的银镜,银镜的光亮程度与反应条件有关;
故答案为:光亮程度;
(5)①银氨溶液的成分为Ag(NH3)2OH,在水中全部电离,电离出:[Ag(NH3)2]+和OH-,当加入稀硝酸时,H+会与氨气和氢氧根离子反应,故与稀硝酸反应的离子方程式为:[Ag(NH3)2]++OH-+3H+=Ag++2NH4++H2O;
故答案为:[Ag(NH3)2]++OH-+3H+=Ag++2NH4++H2O;
②铁比银活泼,故加入的铁粉可以把Ag+从其溶液中还原,加过量的铁粉可以将溶液中的Ag+全部还原,加入铁粉要过量的目的是使溶液中的Ag+反应完全;
故答案为:使溶液中的Ag+全部还原.
点评:本题考查乙醛的银镜反应,侧重于除油污、保证银镜的生成、化学方程式的书写、乙醛进行银镜反应的最佳实验条件探究,题目难度中等,注意银镜反应实验成功的关键因素.对比实验、银镜反应的实验条件、各条件对反应速率的影响.

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
下列各组物质,不能由组成它的两种元素单质直接化合得到的是( )
| A、FeS |
| B、CuS |
| C、Fe3O4 |
| D、Al2S3 |
火箭动力通常采用N2H4(联氨)和N2O4做推进剂,反应温度达2700℃,反应式为:2N2H4+N2O4=3N2+4H2O.下列说法正确的是( )
| A、H2O即不是氧化产物也不是还原产物 |
| B、N2H4作氧化剂 |
| C、属于置换反应 |
| D、有单质生成的反应一定属于氧化还原反应 |
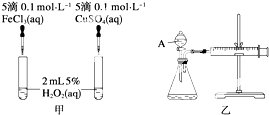 为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是( )
为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是( )| A、图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小 |
| B、若图甲所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好 |
| C、用图乙所示装置测定反应速率,可测定反应产生的气体体积及反应时间 |
| D、为检查图乙所示装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位 |
下列关于物质分离的实验说法正确的是( )
| A、用过滤的方法得到食盐水中的NaCl |
| B、用蒸发的方法从碳酸钙的悬浊液总提取碳酸钙 |
| C、用蒸发的方法得到海水中的水 |
| D、对医用酒精进行蒸馏操作可以得到更高纯度的酒精溶液 |
有关青霉素的说法中不正确的是( )
| A、青霉素G是一种良效广谱抗生素 |
| B、青霉素的结构骨干中均有青霉酸 |
| C、青霉素最初是在青酶的培养液中取得的 |
| D、青霉素在使用前不需要做皮肤敏感实验 |
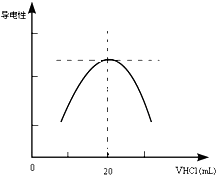 某学习小组甲利用中和反应原理和DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点.请回答:
某学习小组甲利用中和反应原理和DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点.请回答: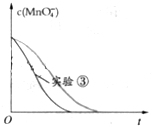 Ⅰ某化学探究小组用H2C2O4(草酸)溶液测定KMnO4溶液的浓度.请回答下列问题:取20.00mL0.2500mol/LH2C2O4标准溶液置于锥形瓶中,加入适量稀硫酸酸化,用KMnO4溶液进行滴定.滴定反应方程式为(未配平):KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O
Ⅰ某化学探究小组用H2C2O4(草酸)溶液测定KMnO4溶液的浓度.请回答下列问题:取20.00mL0.2500mol/LH2C2O4标准溶液置于锥形瓶中,加入适量稀硫酸酸化,用KMnO4溶液进行滴定.滴定反应方程式为(未配平):KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O