题目内容
(1)配制0.1mol?L-1的NaOH溶液时,下列操作会导致实际浓度偏高的是 .
A.使用的砝码部分生锈
B.定容时俯视容量瓶的刻度线
C.选用的容量瓶内残留有少量蒸馏水
D.定容、摇匀后,发现液面低于刻度线,再加水至刻度线
(2)按要求填空:
①用已准确称量的1.06gNa2CO3固体配制0.100mol?L-1Na2CO3溶液100mL,所需要的仪器为 .
②除去Na2CO3固体中混有少量的KNO3,所进行的实验操作依次为 、蒸发、结晶、 .
③除去KCl溶液中的SO42-,依次加入的试剂为(填溶质的化学式) , , .
A.使用的砝码部分生锈
B.定容时俯视容量瓶的刻度线
C.选用的容量瓶内残留有少量蒸馏水
D.定容、摇匀后,发现液面低于刻度线,再加水至刻度线
(2)按要求填空:
①用已准确称量的1.06gNa2CO3固体配制0.100mol?L-1Na2CO3溶液100mL,所需要的仪器为
②除去Na2CO3固体中混有少量的KNO3,所进行的实验操作依次为
③除去KCl溶液中的SO42-,依次加入的试剂为(填溶质的化学式)
考点:配制一定物质的量浓度的溶液
专题:
分析:(1)根据c=
并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
(2)①根据配制步骤是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
②根据KNO3固体和Na2CO3的溶解度随温度的变化趋势来确定提纯方法;
③根据除杂时注意不能引入新的杂质.
| n |
| V |
(2)①根据配制步骤是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
②根据KNO3固体和Na2CO3的溶解度随温度的变化趋势来确定提纯方法;
③根据除杂时注意不能引入新的杂质.
解答:
解:(1)A.砝码部分生锈,质量变大,而m物=m砝+m游,故药品的质量偏大,则所配溶液的浓度偏高,故A选;
B.定容时俯视容量瓶的刻度线,溶液体积偏小,则浓度偏高,故B选;
C.若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故C不选;
D.定容、摇匀后,发现液面低于刻度线是正常的,再加水至刻度线则浓度偏低,故D不选.
故选AB;
(2)①操作步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到100mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有托盘天平、烧杯、玻璃棒、100mL容量瓶、胶头滴管,
故答案为:托盘天平、烧杯、玻璃棒、100mL容量瓶、胶头滴管;
②KNO3固体的溶解度随温度的升高明显增大,Na2CO3固体的溶解度受温度变化影响较小,如提纯硝酸钾,就要让硝酸钾成为晶体析出,所以用降温结晶的方法,步骤是:溶解、加热蒸发、冷却、结晶、过滤,故答案为:溶解;过滤;
③除去KCl溶液中的SO42-,应先加入过量BaCl2的使SO42-生成沉淀,然后加入K2CO3使过量的BaCl2生成沉淀,过滤后加入HCl除去过量的K2CO3,
故答案为:BaCl2;K2CO3;HCl.
B.定容时俯视容量瓶的刻度线,溶液体积偏小,则浓度偏高,故B选;
C.若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故C不选;
D.定容、摇匀后,发现液面低于刻度线是正常的,再加水至刻度线则浓度偏低,故D不选.
故选AB;
(2)①操作步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到100mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有托盘天平、烧杯、玻璃棒、100mL容量瓶、胶头滴管,
故答案为:托盘天平、烧杯、玻璃棒、100mL容量瓶、胶头滴管;
②KNO3固体的溶解度随温度的升高明显增大,Na2CO3固体的溶解度受温度变化影响较小,如提纯硝酸钾,就要让硝酸钾成为晶体析出,所以用降温结晶的方法,步骤是:溶解、加热蒸发、冷却、结晶、过滤,故答案为:溶解;过滤;
③除去KCl溶液中的SO42-,应先加入过量BaCl2的使SO42-生成沉淀,然后加入K2CO3使过量的BaCl2生成沉淀,过滤后加入HCl除去过量的K2CO3,
故答案为:BaCl2;K2CO3;HCl.
点评:本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

练习册系列答案
相关题目
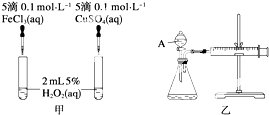 为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是( )
为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是( )| A、图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小 |
| B、若图甲所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好 |
| C、用图乙所示装置测定反应速率,可测定反应产生的气体体积及反应时间 |
| D、为检查图乙所示装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位 |
下列关于物质分离的实验说法正确的是( )
| A、用过滤的方法得到食盐水中的NaCl |
| B、用蒸发的方法从碳酸钙的悬浊液总提取碳酸钙 |
| C、用蒸发的方法得到海水中的水 |
| D、对医用酒精进行蒸馏操作可以得到更高纯度的酒精溶液 |
已知:常温下,0.01mol?L-1 BOH溶液的pH为11,BOH(aq)与H2SO4(aq)反应生成1mol正盐的△H=-26.4kJ?mol-1.则BOH在水溶液中电离的△H为( )
| A、-70.5 kJ?mol-1 |
| B、-44.1 kJ?mol-1 |
| C、70.5 kJ?mol-1 |
| D、44.1 kJ?mol-1 |
 Ⅰ某化学探究小组用H2C2O4(草酸)溶液测定KMnO4溶液的浓度.请回答下列问题:取20.00mL0.2500mol/LH2C2O4标准溶液置于锥形瓶中,加入适量稀硫酸酸化,用KMnO4溶液进行滴定.滴定反应方程式为(未配平):KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O
Ⅰ某化学探究小组用H2C2O4(草酸)溶液测定KMnO4溶液的浓度.请回答下列问题:取20.00mL0.2500mol/LH2C2O4标准溶液置于锥形瓶中,加入适量稀硫酸酸化,用KMnO4溶液进行滴定.滴定反应方程式为(未配平):KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O