题目内容
19.软锰矿的主要成分是MnO2,其悬浊液可吸收烟气中SO2,所得酸性浸出液又可用于制备高纯硫酸锰,其一种工艺流程如图1所示.回答下列问题: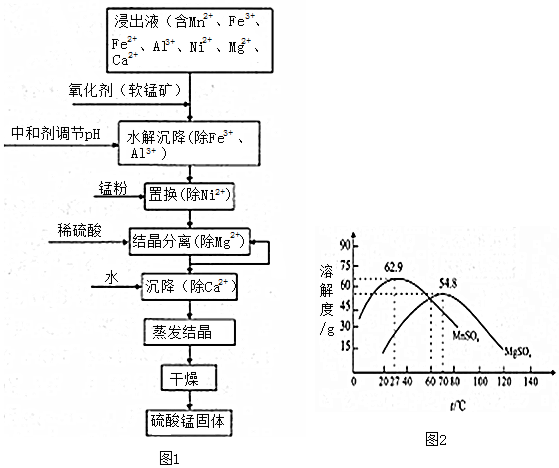
(1)软锰矿悬浊液吸收SO2的过程中,SO2体现了还原 性.
(2)“氧化剂”发生反应的离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O.
(3)已知:Ksp[Al(OH) 3]=1.0×10-34;
Krp[Fe(OH) 3]=2.6×10-30;
Krp[Ni(OH) 2]=1.6×10-15;
Krp[Mn(OH) 2]=4.0×10-14;
“水解沉淀“中:
①“中和剂“可以是C(填标号)
A.Al2O3 B.H2SO4 C.MgO D.MnO2
②溶液的pH应不低于4.3(离子浓度小于1×10-5mol•L-1时,即可认为该离子沉淀完全)
③不采用“水解沉淀“除Ni2+的原因是Ni2+完全沉淀的pH与Mn2+比较相近,不利于两者分离.
(4)“置换”中发生反应的离子方程式为Mn+Ni2+=Mn2++Ni.
(5)“结晶分离”中的部分物质的溶解度曲线如图2.
①加入稀硫酸的作用是增大SO42-的浓度,使MnSO4和MgSO4的溶解度下降,便于结晶析出(结合平衡移动原理解释).
②结晶与过滤过程中,体系温度均应维持在70℃(填“27”、“60”或“70”).
(6)高纯硫酸锰可用于水中溶解氧含量的测定,步骤如下:
步骤1:水中的氧气在碱性溶液中将MnSO4氧化为Mn(OH)2.
步骤2:在酸性条件下,加入KI将生成的MnO(OH)2再还原成Mn2+.
步骤3:用Na2S2O3标准溶液滴定步骤2中生成的I2(2S2O32-+I2═2I-+S4O62-).
取某水样100mL,按上述测定步骤滴定,消耗a mol•L-1NaS2O3标准溶液VmL,该水样溶解氧含量为$\frac{aV}{400}$ mol•L-1.
分析 (1)软锰矿的主要成分是MnO2,其悬浊液可吸收烟气中SO2,二氧化硫被二氧化锰氧化为硫酸;
(2)“氧化剂”发生反应是利用二氧化锰氧化亚铁离子为铁离子,二氧化锰被还原为锰离子;
(3)①中和剂是调节溶液PH除去铁离子、铝离子等杂质离子,且不引入新的杂质;
②Ksp[Al(OH) 3]=1.0×10-34;Krp[Fe(OH) 3]=2.6×10-30;保证铝离子沉淀,铁离子全部沉淀,结合溶度积常数计算,离子浓度小于1×10-5mol•L-1时,即可认为该离子沉淀完全;
③Krp[Ni(OH) 2]=1.6×10-15,Krp[Mn(OH)2]=4.0×10-14,Ni2+完全沉淀的pH与Mn2+比较相近;
(4)“置换”中发生反应是锰置换镍;
(5)①加入稀硫酸的作用是增大硫酸根离子浓度减少硫酸锰和硫酸镁的溶解性;
②结晶与过滤过程中,体系温度均应维持在硫酸镁溶解度最大,此时硫酸锰溶解度小便于析出硫酸锰晶体;
(6)MnSO4~MnO(OH)2~2KI~I2~$\frac{1}{2}$O2~2S2O32-,结合定量关系计算.
解答 解:(1)软锰矿悬浊液吸收SO2的过程中,SO2体现了还原性,
故答案为:还原;
(2)“氧化剂”发生反应是利用二氧化锰氧化亚铁离子为铁离子,二氧化锰被还原为锰离子,反应的离子方程式为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,
故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(3)①中和剂是调节溶液PH除去杂质离子,且不引入新的杂质,
A.Al2O3 若和酸反应会引入铝离子杂质,故A错误;
B.H2SO4 加入后不能调节溶液PH,且引入新的杂质,故B错误;
C.MgO 加入和酸反应能调节溶液PH且不引入新的杂质,故C正确;
D.MnO2 不能和稀酸反应,故D错误;
故答案为:C;
②Ksp[Al(OH) 3]=1.0×10-34;Krp[Fe(OH) 3]=2.6×10-30;比较溶度积可知,铝离子全部沉淀,铁离子已全部沉淀,结合氢氧化铝溶度积常数可知,
Ksp[Al(OH) 3]=1.0×10-34=c(Al3+)c3(OH-),计算得到c(OH-)=$1{0}^{-\frac{29}{3}}$,c(H+)=$\frac{1{0}^{-14}}{c(O{H}^{-})}$=$1{0}^{\frac{13}{3}}$,PH=4.3,
故答案为:4.3;
③Krp[Ni(OH) 2]=1.6×10-15,Krp[Mn(OH)2]=4.0×10-14,Ni2+完全沉淀的pH与Mn2+比较相近不采用“水解沉淀“除Ni2+,
故答案为:Ni2+完全沉淀的pH与Mn2+比较相近,不利于两者分离;
(4)“置换”中发生反应是锰置换镍,反应的离子方程式为Mn+Ni2+=Mn2++Ni,
故答案为:Mn+Ni2+=Mn2++Ni;
(5)①加入稀硫酸的作用是增大SO42-的浓度,沉淀溶解平衡逆向进行,使MnSO4和MgSO4的溶解度下降,便于结晶析出,
故答案为:增大SO42-的浓度,使MnSO4和MgSO4的溶解度下降,便于结晶析出;
②图象中溶解度变化趋势判断,结晶与过滤过程中,体系温度均应维持在70°C,硫酸镁溶解度最大,此时硫酸锰溶解度小便于析出硫酸锰晶体,
故答案为:70;
(6)过程中存在定量关系:
MnSO4~MnO(OH)2~2KI~I2~$\frac{1}{2}$O2~2S2O32-,
0.5 2
n amol/L×V×10-3L
n=0.25aV×10-3mol,
100mL水样溶解氧含量=$\frac{aV}{400}$ mol•L-1 ,
故答案为:$\frac{aV}{400}$.
点评 本题考查了物质组成、物质含量测定、混合物分离提纯、溶度积常数计算,主要是反应现象和定量关系的计算,掌握基础是解题关键,题目难度中等.

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.下列说法不正确的是( )
铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.下列说法不正确的是( )| A. | 在正极发生的电极反应为:AgO+2e-+H2O=Ag+2OH- | |
| B. | 在正极区H+浓度增大,在负极区H+浓度减少 | |
| C. | 该电池总反应的化学方程式:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O | |
| D. | 当电池负极的质量变化10.8g,则过程中电池流动的电子物质的量为1.2NA |
| A. | Na2O2 | B. | CaCL2 | C. | 氮气 | D. | CCL4 |
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 明矾溶于水产生Al(OH)3胶体:Al3++3H2O═Al(OH)3↓+3H+ | |
| C. | Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| D. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
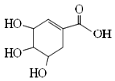
| A. | 分子式为C7H6O5 | B. | 分子中含有两种官能团 | ||
| C. | 1mol该有机物能与4molNaOH反应 | D. | 可发生加成和取代反应 |
| A. | 2016年命名的含有173个中子的113号元素:${\;}_{113}^{173}$Nh | |
| B. | 对硝基甲苯的结构简式: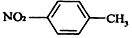 | |
| C. | CSO的电子式: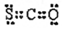 | |
| D. | F-的离子结构示意图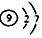 |
| A. | 氯化铵和草木灰混合使用,能增强化肥的肥效 | |
| B. | 二氧化硫和漂白粉混合使用,能增强漂白效果 | |
| C. | 浓盐酸和高锰酸钾混合使用,能增强高锰酸钾的氧化性 | |
| D. | 氢氧化钠固体和氧化钙混合使用,能增加吸水能力 |
| A. |  二溴乙烷 二溴乙烷 | B. |  3乙基1丁烯 3乙基1丁烯 | ||
| C. |  2甲基2,4己二烯 2甲基2,4己二烯 | D. |  2,4,4三甲基戊烷 2,4,4三甲基戊烷 |
| A. | 盛放食醋 | B. | 烧煮开水 | C. | 盛放咸的食物 | D. | 用碱水洗涤 |