题目内容
20.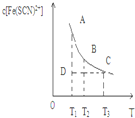 FeCl3与KSCN混合时存在下列平衡:Fe3++SCN-?[Fe( SCN)]2+.已知平衡时,物质的量浓度c[Fe(SCN)]2+与温度T的关系如图,则下列说法正确的是( )
FeCl3与KSCN混合时存在下列平衡:Fe3++SCN-?[Fe( SCN)]2+.已知平衡时,物质的量浓度c[Fe(SCN)]2+与温度T的关系如图,则下列说法正确的是( )| A. | FeCl3与KSCN反应的热化学反应方程式为:Fe3++SCN-?[Fe( SCN)]2+△H>0 | |
| B. | 温度为T1、T2时,反应的平衡常数分别为K1、K2,则K1>K2 | |
| C. | 反应处于D点时,一定有V正>V逆 | |
| D. | T2温度下,向B点溶液中加入FeCl3 固体,平衡状态会从 B点变到A点 |
分析 图象中曲线上的A、B、C三点为不同温度下的平衡状态,D在曲线下方,为处于平衡状态,c[Fe(SCN)2+]比平衡状态小,应向正反应方向移动,随着温度的升高c[Fe(SCN)2+]逐渐减小,说明反应放热,升高温度平衡向逆反应方向移动.
解答 解:A.随着温度的升高c[Fe(SCN)2+]逐渐减小,说明逆反应是吸热反应,正反应放热,△H<0,故A错误;
B.反应放热,升高温度平衡向逆反应方向移动,则K减小,所以温度为T1<T2时,反应的平衡常数分别为K1、K2,则K1>K2,故B正确;
C.D在曲线下方,为处于平衡状态,c[Fe(SCN)2+]比平衡状态小,应向正反应方向移动,V正>V逆,故C正确;
D.T2温度下,向B点溶液中加入FeCl3 固体,平衡正向进行反应放热,温度升高,不可能B到A温度降低,故D错误.
故选BC.
点评 本题考查化学平衡图象问题,题目难度中等,本题注意分析图象中曲线的变化特征,把握温度对平衡移动的影响,此为解答该题的关键.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
12.下列关于物质用途的叙述中不正确的是( )
| A. | Na2O2可用作呼吸面具中的供氧剂 | |
| B. | 浓硫酸在常温下不能与铜片反应放出二氧化硫气体 | |
| C. | Al(OH)3可作治疗胃酸过多的一种药剂 | |
| D. | 四氧化三铁俗称铁红,可用于作油漆、红色涂料 |
13.下列热化学方程式中,正确的是( )
| A. | 甲烷的燃烧热为890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成NH3(g)放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| D. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H20(l)△H=-571.6kJ•mol-1 |
8.某水溶液中只可能含有K+、Mg2+、AlO2-、Al3+、CO32-、SO42-中的若干种离子.某同学对溶液进行了如下实验
i)取溶液少量加入过量稀盐酸,有气体放出
ii)向上一步骤所得溶液中加入过量的氨水,形成白色沉淀
下列判断错误的是( )
i)取溶液少量加入过量稀盐酸,有气体放出
ii)向上一步骤所得溶液中加入过量的氨水,形成白色沉淀
下列判断错误的是( )
| A. | 原溶液中一定含有CO32- | |
| B. | 原溶液中一定含有K+ | |
| C. | 原溶液中一定含有Al3+ | |
| D. | 不能确定SO42-是否存在于原溶液中 |
15. 如图是两种有机分子的比例模型(
如图是两种有机分子的比例模型( 表示碳原子,
表示碳原子, 表示氢原子,
表示氢原子, 表示氧原子,下列有关叙述不正确的是( )
表示氧原子,下列有关叙述不正确的是( )
 如图是两种有机分子的比例模型(
如图是两种有机分子的比例模型( 表示碳原子,
表示碳原子, 表示氢原子,
表示氢原子, 表示氧原子,下列有关叙述不正确的是( )
表示氧原子,下列有关叙述不正确的是( )| A. | 甲、乙都含有羧基 | |
| B. | 甲、乙两物质都能和活泼金属钠反应放出H2 | |
| C. | 甲可以在一定条件下和乙反应生成酯 | |
| D. | 甲、乙两物质的分子式分别为C3H6O3、C2H602 |
5. 已知乙醇在加热的条件下可与HBr反应得到溴乙烷(CH3CH2Br),二者某些物理性质如下表所示:
已知乙醇在加热的条件下可与HBr反应得到溴乙烷(CH3CH2Br),二者某些物理性质如下表所示:
某研究性学习小组的同学将乙醇、80%的硫酸、NaBr固体按一定比例混合后(总体积约140mL)置于图1
的反应容器B中后进行加热(两个装置中的加热、固定装置及沸石均省略).
(1)①仪器A的名称是:冷凝管;②容器B的容积是:c,
a.150mL b.200mL c.250mL
(2)两个水槽中的液体均是冰水,使用冰水的目的是降温,减少溴乙烷的挥发.
(3)HBr与乙醇反应生成目标产物的化学方程式HBr+C2H5OH$\stackrel{加热}{→}$C2H5Br+H2O.
(4)图1中收集到的产品中含有一定量的杂质Br2.为除去该杂质,可先向混合液中加入适量的(从下面所给试剂中选取)b,然后再进行分液操作即可.
a.四氯化碳 b.碳酸钠稀溶液 c.无水CaCl2 d.无水MgSO4
(5)经过(4)处理后的目标产物中还含有少量的水等杂质,可通过向产品中加入一定量的cd(从上面的a~d中选取),充分作用后,过滤,将滤液使用图2中的装置进行提纯,冷却水应从a口(填a或b)进入.
(6)若实验中使用的无水乙醇的体积是46mL,蒸馏后得到的纯溴乙烷的体积是50rnL,则溴乙烷的产率为80%.
 已知乙醇在加热的条件下可与HBr反应得到溴乙烷(CH3CH2Br),二者某些物理性质如下表所示:
已知乙醇在加热的条件下可与HBr反应得到溴乙烷(CH3CH2Br),二者某些物理性质如下表所示:| 溶解性(本身均做溶剂) | 沸点(℃) | 密度(g/mL) | |
| 水混溶,易溶于有机溶剂 | 78.5 | 0.8 | |
| 难溶于水,易溶于有机溶剂 | 38.4 | 1.4 |
的反应容器B中后进行加热(两个装置中的加热、固定装置及沸石均省略).
(1)①仪器A的名称是:冷凝管;②容器B的容积是:c,
a.150mL b.200mL c.250mL
(2)两个水槽中的液体均是冰水,使用冰水的目的是降温,减少溴乙烷的挥发.
(3)HBr与乙醇反应生成目标产物的化学方程式HBr+C2H5OH$\stackrel{加热}{→}$C2H5Br+H2O.
(4)图1中收集到的产品中含有一定量的杂质Br2.为除去该杂质,可先向混合液中加入适量的(从下面所给试剂中选取)b,然后再进行分液操作即可.
a.四氯化碳 b.碳酸钠稀溶液 c.无水CaCl2 d.无水MgSO4
(5)经过(4)处理后的目标产物中还含有少量的水等杂质,可通过向产品中加入一定量的cd(从上面的a~d中选取),充分作用后,过滤,将滤液使用图2中的装置进行提纯,冷却水应从a口(填a或b)进入.
(6)若实验中使用的无水乙醇的体积是46mL,蒸馏后得到的纯溴乙烷的体积是50rnL,则溴乙烷的产率为80%.
12.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 2.3g金属钠在一定条件下生成Na2O和Na2O2的混合物时,钠失去的电子数目为0.1NA | |
| B. | 22.4L氧气中所含的分子数目为NA | |
| C. | 1mol/L Na2CO3溶液中含有Na+离子数目是NA | |
| D. | 17g氨气中所含氢原子数目为4NA |
9.化学与生活密切相关,下列说法正确的是( )
| A. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| B. | 煎炸食物的花生油和牛油都是可皂化的酯类 | |
| C. | 合成橡胶与光导纤维都属于有机高分子材料 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |