题目内容
10.已知A是气体单质,E的水溶液显强酸性.A、B、C、D、E是含有一种相同元素的五种物质,在一定条件下可发生下图所示的转化.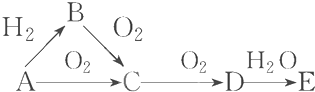
(1)写出化学式:BNH3,DNO2,EHNO3.
(2)写出化学方程式
B→C:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
D→E:3NO2+H2O=2HNO3+NO.
分析 A是气体单质,A能和氢气反应,则A是非金属单质,A能被氧气氧化生成C,C能被氧化生成D,则A在氧化物中是变价元素,E的水溶液显强酸性,则E是非金属性较强的元素,氮气和氢气反应生成氨气,氨气和氧气反应生成一氧化氮和水,氮气和氧气反应生成一氧化氮,一氧化氮和氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸,硝酸是强酸,所以A为N2,B为NH3,C为NO,D为NO2,E为HNO3,据此分析回答.
解答 解:A是气体单质,A能和氢气反应,则A是非金属单质,A能被氧气氧化生成C,C能被氧化生成D,则A在氧化物中是变价元素,E的水溶液显强酸性,则E是非金属性较强的元素,氮气和氢气反应生成氨气,氨气和氧气反应生成一氧化氮和水,氮气和氧气反应生成一氧化氮,一氧化氮和氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸,硝酸是强酸,所以A为N2,B为NH3,C为NO,D为NO2,E为HNO3,
(1)B、D、E分别为:NH3,NO2,HNO3,
故答案为:NH3,NO2,HNO3;
(2)B-C的反应为氨气的催化氧化反应生成一氧化氮和水,反应的化学方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,D-E的反应为3NO2+H2O=2HNO3+NO,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,3NO2+H2O=2HNO3+NO.
点评 本题考查了无机物转化关系和元素化合物的性质,明确物质之间的反应及其性质是解本题关键,难度不大.

练习册系列答案
相关题目
20.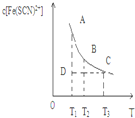 FeCl3与KSCN混合时存在下列平衡:Fe3++SCN-?[Fe( SCN)]2+.已知平衡时,物质的量浓度c[Fe(SCN)]2+与温度T的关系如图,则下列说法正确的是( )
FeCl3与KSCN混合时存在下列平衡:Fe3++SCN-?[Fe( SCN)]2+.已知平衡时,物质的量浓度c[Fe(SCN)]2+与温度T的关系如图,则下列说法正确的是( )
 FeCl3与KSCN混合时存在下列平衡:Fe3++SCN-?[Fe( SCN)]2+.已知平衡时,物质的量浓度c[Fe(SCN)]2+与温度T的关系如图,则下列说法正确的是( )
FeCl3与KSCN混合时存在下列平衡:Fe3++SCN-?[Fe( SCN)]2+.已知平衡时,物质的量浓度c[Fe(SCN)]2+与温度T的关系如图,则下列说法正确的是( )| A. | FeCl3与KSCN反应的热化学反应方程式为:Fe3++SCN-?[Fe( SCN)]2+△H>0 | |
| B. | 温度为T1、T2时,反应的平衡常数分别为K1、K2,则K1>K2 | |
| C. | 反应处于D点时,一定有V正>V逆 | |
| D. | T2温度下,向B点溶液中加入FeCl3 固体,平衡状态会从 B点变到A点 |
1.某学生做中和滴定实验的过程如下:
a.取一支碱式滴定管;
b.用蒸馏水洗净;
c.加入待测NaOH溶液;
d.记录液面刻度读数;
e.用酸式滴定管精确放出一定量标准酸液;
f.置于未经标准酸液润洗的洁净锥形瓶中;
g.加入适量蒸馏水;
h.加入酚酞试液2滴;
i.滴定时,边滴边摇动;
j.边注视滴定管内液面的变化;
k.当刚滴到溶液由无色变成粉红色时,即停止滴定;
l.记录液面读数;
m.根据滴定管的两次得出NaOH溶液的体积为22mL.
上述实验过程中的错误之处有( )
a.取一支碱式滴定管;
b.用蒸馏水洗净;
c.加入待测NaOH溶液;
d.记录液面刻度读数;
e.用酸式滴定管精确放出一定量标准酸液;
f.置于未经标准酸液润洗的洁净锥形瓶中;
g.加入适量蒸馏水;
h.加入酚酞试液2滴;
i.滴定时,边滴边摇动;
j.边注视滴定管内液面的变化;
k.当刚滴到溶液由无色变成粉红色时,即停止滴定;
l.记录液面读数;
m.根据滴定管的两次得出NaOH溶液的体积为22mL.
上述实验过程中的错误之处有( )
| A. | f.g.k.m | B. | c.j.k.m | C. | c.h.i.k | D. | f.g.h.j. |
5.已知A、B、C、D和E,五种分子所含原子数目依次为1、2、3、4和6,且都含有18个电子.又知B、C和D是由两种元素的原子组成.下列说法正确的是( )
| A. | A分子的原子的核外电子排布式是1s22s22p63s23p4 | |
| B. | 向D的溶液中加入少量二氧化锰,一定有无色气体生成. | |
| C. | 还原性强弱B>C | |
| D. | 若将1mol E在氧气中完全燃烧,只生成1mol CO2和2molH2O,则E的分子式是CH4O |
15.能用H++OH-═H2O表示的是( )
| A. | NaOH溶液和CO2的反应 | B. | Ba(OH)2溶液和稀硫酸的反应 | ||
| C. | NaOH溶液和稀硫酸反应 | D. | 氨水和稀硫酸的反应 |
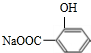
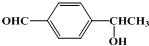
19.下列有机物不是同一种物质的是( )
| A. | 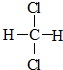 和 和  | B. | CH2=CH-CH=CH2和  | ||
| C. | 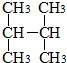 和 和 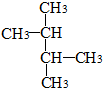 | D. | C(CH3)3C(CH3)3和CH3(CH2)3C(CH3)3 |
20. 钠及其化合物具有广泛的用途.
钠及其化合物具有广泛的用途.
(1)工业上制备金属钠的常用方法是电解法.试写出制备金属钠的化学方程式2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑.金属钠可用于液态钠可作核反应堆的传热介质 (写出Na在熔点低方面的一种用途).
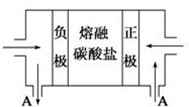
(2)用Na2CO3熔融盐作电解质,CO、O2、CO2为原料可组成新型电池.该电池的结构如图所示:
①正极的电极反应式为O2+4e-+2CO2=2CO32-,电池工作时物质A可循环使用,A物质的化学式为CO2.
②请写出检验Na2CO3中钠元素的方法取一根洁净的铂丝蘸取碳酸钠粉末或碳酸钠溶液,放在酒精灯外焰上灼烧,观察火焰的颜色.
(3)常温下,浓度均为0.1mol•L-1的下列五种钠盐溶液的pH如下表:
上述盐溶液的阴离子中,结合H+能力最强的是CO32-,根据表中数据,浓度均为0.01mol•L-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是c(填序号).
a.HCN b.HClO c.CH3COOH d.H2CO3
(4)实验室中常用NaOH来进行尾气处理、洗气和提纯.
①常温下,当300mL 1mol•L-1的NaOH溶液吸收4.48L(折算成标准状况)SO2时,所得溶液pH>7,则溶液中各离子浓度由大到小的顺序为c(Na+)>c(HSO)>c(SO)>c(OH-)>c(H+).
②已知几种离子开始沉淀时的pH如下表:
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加某浓度的NaOH溶液时,Cu2+(填离子符号)先沉淀,Ksp[Fe(OH)2]<Ksp[Mg(OH)2](填“>”、“=”或“<”).
 钠及其化合物具有广泛的用途.
钠及其化合物具有广泛的用途.(1)工业上制备金属钠的常用方法是电解法.试写出制备金属钠的化学方程式2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑.金属钠可用于液态钠可作核反应堆的传热介质 (写出Na在熔点低方面的一种用途).
(2)用Na2CO3熔融盐作电解质,CO、O2、CO2为原料可组成新型电池.该电池的结构如图所示:
①正极的电极反应式为O2+4e-+2CO2=2CO32-,电池工作时物质A可循环使用,A物质的化学式为CO2.
②请写出检验Na2CO3中钠元素的方法取一根洁净的铂丝蘸取碳酸钠粉末或碳酸钠溶液,放在酒精灯外焰上灼烧,观察火焰的颜色.
(3)常温下,浓度均为0.1mol•L-1的下列五种钠盐溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaCO | NaCN |
| pH | 8.8 | 9.7 | .6 | 0.3 | 11.1 |
a.HCN b.HClO c.CH3COOH d.H2CO3
(4)实验室中常用NaOH来进行尾气处理、洗气和提纯.
①常温下,当300mL 1mol•L-1的NaOH溶液吸收4.48L(折算成标准状况)SO2时,所得溶液pH>7,则溶液中各离子浓度由大到小的顺序为c(Na+)>c(HSO)>c(SO)>c(OH-)>c(H+).
②已知几种离子开始沉淀时的pH如下表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
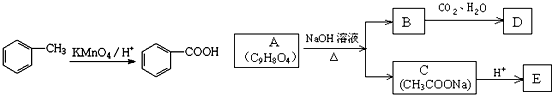
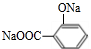 ,
,

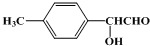 、
、
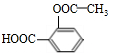 +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$