题目内容
t ℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)  2Z(g),各组分在不同时刻的浓度如下表,下列说法正确的是:
2Z(g),各组分在不同时刻的浓度如下表,下列说法正确的是:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
2 min末浓度/mol·L-1 | 0.08 | a | b |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
A.平衡时,X的转化率为20%
B.t ℃时,该反应的平衡常数为40
C.增大平衡后的体系压强, v正增大,v逆减小,平衡向正反应方向移动
D.前2 min内,用Y的变化量表示的平均反应速率v(Y) = 0.03 mol·L-1·min-1
D
【解析】
试题分析:根据三行式分析:X + 3Y  2Z
2Z
初始浓度(mol?L?1) 0.1 0.2 0
转化浓度(mol?L?1)0.05 0.15 0.1
平衡浓度(mol?L?1)0.05 0.05 0.1
A、平衡时,X的转化率=0.05mol/L÷0.1mol/L×100%=50%,错误;B、平衡常数=0.12÷(0.05×0.053)=1600,错误;C、增大平衡后的体系压强,正反应速率、逆反应速率都增大,错误;D、前2 min内,用Y的变化量表示的平均反应速率v(Y) =3v(X)=3×(0.1mol?L?1-0.08mol?L?1)÷2min=0.03 mol·L-1·min-1,正确。
考点:考查化学反应速率、化学平衡。

下列实验操作与预期实验目的或实验结论一致的是
选项 | 实验操作及现象 | 实验目的或结论 |
A | 测同浓度的Na2CO3、CH3COONa 溶液的PH值前者大 | 酸性强弱:CH3COOH 比H2CO3强 |
B | 向Na2SiO3溶液中通入CO2 出现浑浊 | 非金属性强弱:C>Si |
C | 向某溶液加入盐酸酸化的氯化钡溶液有沉淀产生 | 说明此溶液中一定含SO42? |
D | 比较H2O和H2S的沸点前者大 | 非金属性:O>S |
| A、分子晶体中,分子间作用力越大分子越稳定 |
| B、分子晶体都是由共价分子构成的 |
| C、离子晶体中可能含有共价键 |
| D、原子晶体中只存在非极性键 |
 Na2S2O3(aq)
Na2S2O3(aq)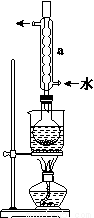
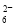 +2I-
+2I-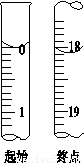
 CH3OH(气) ;ΔH<0为了增加甲醇的产量,工厂应采取正确的措施是
CH3OH(气) ;ΔH<0为了增加甲醇的产量,工厂应采取正确的措施是