题目内容
有关化学键和晶体的叙述中正确的是( )
| A、分子晶体中,分子间作用力越大分子越稳定 |
| B、分子晶体都是由共价分子构成的 |
| C、离子晶体中可能含有共价键 |
| D、原子晶体中只存在非极性键 |
考点:化学键
专题:
分析:A.分子晶体的稳定性与化学键有关;
B.单原子分子中没有化学键;
C.离子晶体中一定存在离子键,可能存在共价键;
D.原子晶体中可能存在极性键,也可能存在非极性键.
B.单原子分子中没有化学键;
C.离子晶体中一定存在离子键,可能存在共价键;
D.原子晶体中可能存在极性键,也可能存在非极性键.
解答:
解:A.分子晶体的稳定性与化学键有关,共价键越强,稳定性越大,而分子间作用力只影响物质的熔沸点,故A错误;
B.单原子分子中没有化学键,如稀有气体为单原子分子,分子中没有共价键,故B错误;
C.离子晶体中一定存在离子键,可能存在共价键,如氢氧化钠、过氧化钠中,故C正确;
D.原子晶体中可能存在极性键,也可能存在非极性键,如二氧化硅、碳化硅晶体中,故D错误;
故选C.
B.单原子分子中没有化学键,如稀有气体为单原子分子,分子中没有共价键,故B错误;
C.离子晶体中一定存在离子键,可能存在共价键,如氢氧化钠、过氧化钠中,故C正确;
D.原子晶体中可能存在极性键,也可能存在非极性键,如二氧化硅、碳化硅晶体中,故D错误;
故选C.
点评:本题考查化学键与晶体的类型等,题目难度不大,注意相关基础知识的积累.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
t ℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)  2Z(g),各组分在不同时刻的浓度如下表,下列说法正确的是:
2Z(g),各组分在不同时刻的浓度如下表,下列说法正确的是:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
2 min末浓度/mol·L-1 | 0.08 | a | b |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
A.平衡时,X的转化率为20%
B.t ℃时,该反应的平衡常数为40
C.增大平衡后的体系压强, v正增大,v逆减小,平衡向正反应方向移动
D.前2 min内,用Y的变化量表示的平均反应速率v(Y) = 0.03 mol·L-1·min-1
 已知草酸为二元弱酸:
已知草酸为二元弱酸:H2C2O4?HC2O4-+H+ Ka1
HC2O4-?C2O42-+H+ Ka2
常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是
( )
| A、pH=1.2溶液中:c(K+)+c(H+)=c(OH-)+c(H2C2O4) |
| B、pH=2.7溶液中:c2(HC2O4-)/[c(H2C2O4)×c(C2O42-)]=1000 |
| C、将相同物质的量KHC2O4和K2C2O4固体完全溶于水可配得pH为4.2的混合液 |
| D、向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离度一直增大 |
下列各组离子可能大量共存的是( )
| A、不能使酚酞试液变红的无色溶液中:Na+、CO32-、K+、ClO- |
| B、能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、NH4+ |
| C、常温下水电离出的c(H+)?c(OH-)=10-20的溶液中:Na+、Cl-、S2-、SO32- |
| D、无色透明溶液:K+、HCO3-、NO3-、SO42-、Fe3+ |
在下列各用途中,利用了物质的氧化性的是( )
| A、用食盐腌制食物 |
| B、用漂粉精消毒游泳池中的水 |
| C、用汽油洗涤衣物上的油污 |
| D、用盐酸除去铁钉表面的铁锈 |
对有机物 的表述不正确的是( )
的表述不正确的是( )
 的表述不正确的是( )
的表述不正确的是( )| A、该物质能发生加成、取代、氧化反应 |
| B、该物质遇FeC13溶液显色,lmol该物质能与2mo1Br2发生取代反应 |
| C、该物质的分子式为C11H15O3 |
| D、1mol该物质最多消耗Na,NaOH,NaHC03的物质的量之比为2:2:1 |
下列实验操作不能达到预期目的是( )
A、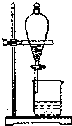 分离CH3COOC2H5和饱和碳酸钠溶液 |
B、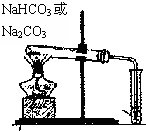 鉴别碳酸钠和碳酸氢钠 |
C、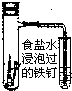 铁的吸氧腐蚀实验 |
D、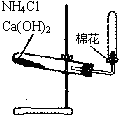 实验室制备氨气 |

 前四周期原子序数依次增大的X、Y、Z、Q、E五种元素中,X元素原子核外有三种不同的能级且各个能级所填充的电子数相同,Z是地壳内含量(质量分数)最高的元素,Q原子核外的M层中只有两对成对电子,E+核外各能层电子均已充满.请回答下列问题:
前四周期原子序数依次增大的X、Y、Z、Q、E五种元素中,X元素原子核外有三种不同的能级且各个能级所填充的电子数相同,Z是地壳内含量(质量分数)最高的元素,Q原子核外的M层中只有两对成对电子,E+核外各能层电子均已充满.请回答下列问题: