题目内容
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性环境中会生成单质S。
Ⅰ制备Na2S2O3·5H2O反应原理:Na2SO3(aq)+S(s) 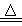 Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水。另取5 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
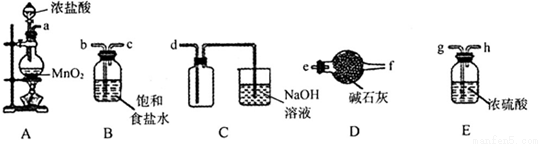
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60 min。
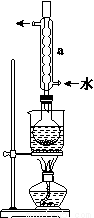
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤、干燥,得到产品。
回答问题:
(1)仪器a的名称是________,其作用是____________________。
(2)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是______________。检验是否存在该杂质的方法是_________________ 。
Ⅱ测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。反应原理为2S2O32-+I2===S4O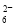 +2I-
+2I-
(3)滴定至终点时,溶液颜色的变化:________________________________。
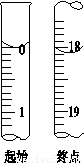
(4)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为______mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________。
(5)如果滴定终点时俯视刻度线,所的结果 (填“偏大”“偏小”或“不变”)
Ⅲ.Na2S2O3的应用
(6)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42-,常用作脱氯剂,该反应的离子方程式为______________________________________ ______。
(1)冷凝管 冷凝回流
(2)Na2SO4、取少量产品溶于过量稀盐酸,过滤,向滤液中加BaCl2溶液,若有白色沉淀,则产品中含有Na2SO4
(3)无色变蓝色
(4)18.10 3.620×10^3M/W×100%
(5)偏小 (6)S2O32- +4Cl2 + 5H2O = 2SO42- +8Cl- +10H+
【解析】
试题分析:(1)根据实验装置图仪器a的结构特点可知a为冷凝管;作用是冷凝回流;(2)Na2SO3具有还原性,易被O2氧化为Na2SO4,所以最可能存在的无机杂质是Na2SO4;硫酸钠的检验方法为:取少量产品溶于过量稀盐酸,过滤,向滤液中加BaCl2溶液,若有白色沉淀,则产品中含有Na2SO4;(3)滴定结束后,I2使淀粉变蓝,所以滴定至终点时,溶液颜色的变化:无色变蓝色;(4)根据液面示意图,滴定起始时,液面读数为0,终点液面读数为18.10ml,所以消耗碘的标准溶液体积为18.10ml;产品的纯度=0.1000mol/L×18.10×10-3L×2M÷W×100%=3.620×10^3M/W×100%;(5)如果滴定终点时俯视刻度线,所读标准碘溶液的体积偏小,所得的结果偏小;(6)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42-,Cl2被还原为Cl?,配平可得离子方程式为:S2O32?+4Cl2+5H2O = 2SO42?+8Cl?+10H+。
考点:本题考查实验基本仪器和基本操作、离子的检验、滴定实验及计算、离子方程式的书写。

t ℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)  2Z(g),各组分在不同时刻的浓度如下表,下列说法正确的是:
2Z(g),各组分在不同时刻的浓度如下表,下列说法正确的是:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
2 min末浓度/mol·L-1 | 0.08 | a | b |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
A.平衡时,X的转化率为20%
B.t ℃时,该反应的平衡常数为40
C.增大平衡后的体系压强, v正增大,v逆减小,平衡向正反应方向移动
D.前2 min内,用Y的变化量表示的平均反应速率v(Y) = 0.03 mol·L-1·min-1
| A、用食盐腌制食物 |
| B、用漂粉精消毒游泳池中的水 |
| C、用汽油洗涤衣物上的油污 |
| D、用盐酸除去铁钉表面的铁锈 |


 Cu+FeS+ SO2 ,FeS+2HCl
Cu+FeS+ SO2 ,FeS+2HCl FeCl2+H2S。
FeCl2+H2S。
 、AlO
、AlO 、K+、S2-等离子
、K+、S2-等离子