题目内容
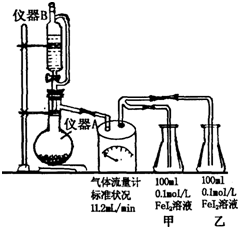 某研究性学习小组为探究Cl2的氧化性和I-的还原性强于Fe2+,设计了如图装置制取Cl2,并进行实验探究.回答下列问题:
某研究性学习小组为探究Cl2的氧化性和I-的还原性强于Fe2+,设计了如图装置制取Cl2,并进行实验探究.回答下列问题:(1)仪器A的名称:
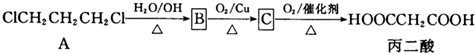
(2)制取Cl2方法有多种:
①用MnO2加热条件下氧化浓盐酸;
②用KMnO4常温下氧化浓盐酸;
③用O2在450℃,催化剂氧化浓盐酸;
三种氧化剂氧化性由强到弱的顺序为:
只用该装置应选用方法是(用离子方程式表示):
(3)为比较I-和Fe2+的还原性强弱,需在甲瓶中滴几滴淀粉试液,目的是
(4)该实验设计最大的缺陷是
(5)当乙瓶中c(Fe2+)=C(Fe3+),瓶内反应的离子方程式为:
考点:性质实验方案的设计
专题:实验题
分析:(1)根据装置图可知,A为蒸馏烧瓶,仪器B连通分液漏斗,保持上下气压相等,使液体顺利流下;
(2)反应条件越苛刻,说明氧化剂的氧化性越弱,该装置没有加热,因此采用KMnO4常温下氧化浓盐酸制取氯气;
(3)淀粉遇碘变蓝色,在甲瓶中滴几滴淀粉试液,可以显示I-被氧化,铁离子可以使KSCN试液变红色,在乙瓶中滴几滴KSCN试液,可以显示Fe2+被氧化;甲瓶比乙瓶先出现颜色变化,说明I-还原性强于Fe2+;
(4)氯气具有刺激性气味,有毒,污染环境,本实验没有尾气吸收装置;
(5)由还原性强弱可知此时I-已全部被氧化,当乙瓶中c(Fe2+)=C(Fe3+)时,Fe2+被氧化一半,根据方程式关系可知需要至少需要的氯气.
(2)反应条件越苛刻,说明氧化剂的氧化性越弱,该装置没有加热,因此采用KMnO4常温下氧化浓盐酸制取氯气;
(3)淀粉遇碘变蓝色,在甲瓶中滴几滴淀粉试液,可以显示I-被氧化,铁离子可以使KSCN试液变红色,在乙瓶中滴几滴KSCN试液,可以显示Fe2+被氧化;甲瓶比乙瓶先出现颜色变化,说明I-还原性强于Fe2+;
(4)氯气具有刺激性气味,有毒,污染环境,本实验没有尾气吸收装置;
(5)由还原性强弱可知此时I-已全部被氧化,当乙瓶中c(Fe2+)=C(Fe3+)时,Fe2+被氧化一半,根据方程式关系可知需要至少需要的氯气.
解答:
解:(1)根据装置图可知,A为蒸馏烧瓶,仪器B连通分液漏斗,保持上下气压相等,使液体顺利流下,
故答案为:蒸馏烧瓶;保持上下气压相等,使液体顺利流下;
(2)反应条件越苛刻,说明氧化剂的氧化性越弱,所以氧化性:KMnO4>MnO2>O2,该装置没有加热,因此采用KMnO4常温下氧化浓盐酸制取氯气,离子方程式为
2MnO4-+16H++10Cl-═2Mn2++5Cl2↑+8H2O,
故答案为:KMnO4>MnO2>O2;2MnO4-+16H++10Cl-═2Mn2++5Cl2↑+8H2O;
(3)淀粉遇碘变蓝色,在甲瓶中滴几滴淀粉试液,可以显示I-被氧化,铁离子可以使KSCN试液变红色,在乙瓶中滴几滴KSCN试液,可以显示Fe2+被氧化,甲瓶比乙瓶先出现颜色变化,说明I-还原性强于Fe2+;
故答案为:显示I-被氧化;显示Fe2+被氧化;甲比乙先出现颜色变化;
(4)氯气具有刺激性气味,有毒,污染环境,本实验没有尾气吸收装置,
故答案为:没有尾气吸收装置;
(5)由还原性强弱可知此时I-已全部被氧化,当乙瓶中c(Fe2+)=C(Fe3+)时,Fe2+被氧化一半,离子方程式为5Cl2+2Fe2++8I-=2Fe3++10Cl-+4I2;
n(I-)=0.1mol/L×0.1L×2=0.02mol,根据方程式关系可知需要至少氯气为(0.02mol×
)×22.4L=0.28L,
故答案为:5Cl2+2Fe2++8I-=2Fe3++10Cl-+4I2;0.28.
故答案为:蒸馏烧瓶;保持上下气压相等,使液体顺利流下;
(2)反应条件越苛刻,说明氧化剂的氧化性越弱,所以氧化性:KMnO4>MnO2>O2,该装置没有加热,因此采用KMnO4常温下氧化浓盐酸制取氯气,离子方程式为
2MnO4-+16H++10Cl-═2Mn2++5Cl2↑+8H2O,
故答案为:KMnO4>MnO2>O2;2MnO4-+16H++10Cl-═2Mn2++5Cl2↑+8H2O;
(3)淀粉遇碘变蓝色,在甲瓶中滴几滴淀粉试液,可以显示I-被氧化,铁离子可以使KSCN试液变红色,在乙瓶中滴几滴KSCN试液,可以显示Fe2+被氧化,甲瓶比乙瓶先出现颜色变化,说明I-还原性强于Fe2+;
故答案为:显示I-被氧化;显示Fe2+被氧化;甲比乙先出现颜色变化;
(4)氯气具有刺激性气味,有毒,污染环境,本实验没有尾气吸收装置,
故答案为:没有尾气吸收装置;
(5)由还原性强弱可知此时I-已全部被氧化,当乙瓶中c(Fe2+)=C(Fe3+)时,Fe2+被氧化一半,离子方程式为5Cl2+2Fe2++8I-=2Fe3++10Cl-+4I2;
n(I-)=0.1mol/L×0.1L×2=0.02mol,根据方程式关系可知需要至少氯气为(0.02mol×
| 5 |
| 8 |
故答案为:5Cl2+2Fe2++8I-=2Fe3++10Cl-+4I2;0.28.
点评:本题考查了氯气的实验室制法,综合性较强,侧重于反应原理、氧化性的比较、离子检验、离子方程式的书写和计算,难度中等,注意根据还原剂强弱判断离子反应.

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
 如图为1mol甲烷在足量的氧气中燃烧生成CO2(g)和H2O(g)时的能量变化示意图,由此图分析得出的下列结论中正确的是( )
如图为1mol甲烷在足量的氧气中燃烧生成CO2(g)和H2O(g)时的能量变化示意图,由此图分析得出的下列结论中正确的是( )| A、甲烷燃烧为吸热反应 |
| B、甲烷的燃烧热△H=-802kJ?mol-1 |
| C、EA-EB=1015kJ |
| D、该反应的热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802kJ?mol-1 |
下列有机物中,属于芳香烃的是( )
A、 |
B、 |
C、 |
D、 |