题目内容
15.某无机盐Y,由三种元素组成,受热可分解.称取4.84g的 Y,完全分解可得1.6g红棕色粉末Z;同时产生两种气体,其中一种成分为O2,O2体积为336mL(已折算成标准状况).若将此混合气体通入水中,可被完全吸收,所得溶液恰能将Z溶解,得到黄色Y溶液,Z通常可用于生产颜料及防锈油漆.请推测并回答:
(1)Z的化学式是Fe2O3.
(2)写出Y受热分解的化学反应方程式4Fe(NO3)3$\frac{\underline{\;\;△\;\;}}{\;}$ 2Fe2O3+12NO2↑+3O2↑.
(3)若向Y的稀溶液中通入SO2,溶液由黄色变成浅绿色,后又变成黄色.写出最初溶液变成浅绿色所发生的离子方程式2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
(4)Z可用于汽车安全气囊中,当其中的NaN3高温分解产生大量N2时,生成的Na可与Z反应生成一种单质及一种化合物.写出该反应的化学方程式Fe2O3+6Na $\frac{\underline{\;\;△\;\;}}{\;}$ 2Fe+3Na2O.
(5)某同学为了检验Y分解所得气体中含有O2,用向上排空气法收集了一试管气体,插入带火星木条,结果木条复燃.请判断该同学的实验方法是否合理并说明理由不合理,NO2也可能有助燃性,能使木条复燃,所以无法证明一定含有O2.
分析 分解生成红棕色粉末Z通常可用于生产颜料及防锈油漆,Z为Fe2O3,将分解得到混合气体通入水中,可被完全吸收,所得溶液恰能将Z溶解,得到黄色Y溶液,则Y含有Fe3+,混合气体与水反应生成相应的酸,由(3)若向Y的稀溶液中通入SO2,溶液由黄色变成浅绿色,铁离子将二氧化硫氧化为硫酸,后又变成黄色,说明酸性条件下,酸根具有强氧化性,可能为NO3-,Fe2O3的物质的量为$\frac{1.6g}{160g/mol}$=0.01mol,根据电荷守恒NO3-应为0.06mol,分解生成的氧气为$\frac{0.336L}{22.4L/mol}$=0.015mol,氧气质量为0.015mol×32g/mol=0.48g,另外气体的质量为4.84g-1.6g-0.48g=2.76g,该气体中N元素质量为0.06mol×14g/mol=0.84g,O元素质量为2.76g-0.84g=1.92g,O原子物质的量为$\frac{1.92g}{16g/mol}$=0.12mol,N原子、O原子数目之比为0.06mol:0.12mol=1:2,该气体为NO2,其物质的量为0.12mol,混合气体通入水发生反应:4NO2+O2+2H2O=4HNO3,恰好完全吸收,生成0.12mol HNO3,恰好溶解0.01mol Fe2O3,验证符合题意,则Y为Fe(NO3)3.
解答 解:分解生成红棕色粉末Z通常可用于生产颜料及防锈油漆,Z为Fe2O3,将分解得到混合气体通入水中,可被完全吸收,所得溶液恰能将Z溶解,得到黄色Y溶液,则Y含有Fe3+,混合气体与水反应生成相应的酸,由(3)若向Y的稀溶液中通入SO2,溶液由黄色变成浅绿色,铁离子将二氧化硫氧化为硫酸,后又变成黄色,说明酸性条件下,酸根具有强氧化性,可能为NO3-,Fe2O3的物质的量为$\frac{1.6g}{160g/mol}$=0.01mol,根据电荷守恒NO3-应为0.06mol,分解生成的氧气为$\frac{0.336L}{22.4L/mol}$=0.015mol,氧气质量为0.015mol×32g/mol=0.48g,另外气体的质量为4.84g-1.6g-0.48g=2.76g,该气体中N元素质量为0.06mol×14g/mol=0.84g,O元素质量为2.76g-0.84g=1.92g,O原子物质的量为$\frac{1.92g}{16g/mol}$=0.12mol,N原子、O原子数目之比为0.06mol:0.12mol=1:2,该气体为NO2,其物质的量为0.12mol,混合气体通入水发生反应:4NO2+O2+2H2O=4HNO3,恰好完全吸收,生成0.12mol HNO3,恰好溶解0.01mol Fe2O3,验证符合题意,则Y为Fe(NO3)3.
(1)Z的化学式是:Fe2O3,故答案为:Fe2O3;
(2)Y受热分解的化学反应方程式:4Fe(NO3)3$\frac{\underline{\;\;△\;\;}}{\;}$ 2Fe2O3+12NO2↑+3O2↑,
故答案为:4Fe(NO3)3$\frac{\underline{\;\;△\;\;}}{\;}$ 2Fe2O3+12NO2↑+3O2↑;
(3)若向Y的稀溶液中通入SO2,溶液由黄色变成浅绿色,后又变成黄色,最初溶液变成浅绿色所发生的离子方程式:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
(4)Na可与Fe2O3反应生成一种单质及一种化合物,反应生成Fe及氧化钠,该反应的化学方程式为:Fe2O3+6Na $\frac{\underline{\;\;△\;\;}}{\;}$ 2Fe+3Na2O,
故答案为:Fe2O3+6Na $\frac{\underline{\;\;△\;\;}}{\;}$ 2Fe+3Na2O;
(5)NO2也可能有助燃性,能使木条复燃,所以无法证明一定含有O2,该同学说法不合理,
故答案为:不合理,NO2也可能有助燃性,能使木条复燃,所以无法证明一定含有O2.
点评 本题考查无机物推断,注意从问题中判断酸根在酸性条件下具有强氧化性,再进行验证,题目难度较大.

 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案| A. | 消耗盐酸一样多 | B. | 放出CO2一样多 | ||
| C. | 消耗盐酸前者多 | D. | 放出的CO2,第一份为第二份的一半 |
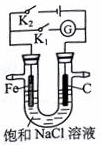
| A. | K1闭合,向铁棒附近滴入K3[Fe(CN)6]溶液,立即有血红色出现 | |
| B. | K2闭合,电流方向由石墨棒经导线流向铁棒 | |
| C. | K2闭合,碳棒上发生还原反应,会生成黄绿色气体 | |
| D. | 将U型管支管封闭并闭合K1一段时间后,U型管中右侧液面会高于左侧液面 |
| A. | 青砖(含Fe3O4)中的Fe2+可用浓盐酸溶解后,再加入适量高锰酸钾溶液进行检验 | |
| B. | 用0.1000 mol•L-1 NaOH溶液滴定20.00 mL未知浓度盐酸,接近终点时因滴速太快造成NaOH少许过量;此时若加入一定体积该盐酸后,继续用该NaOH溶液恰好滴定至终点,则测得的盐酸浓度将偏大 | |
| C. | 为了使实验现象明显,在做吸氧腐蚀实验时,不能用没有处理过的镀锌铁皮代替生铁 | |
| D. | 检查容量瓶瓶口是否漏水的方法是:往瓶内加入一定量水,塞好瓶塞.用食指摁住瓶塞,另一只手托住瓶底,把瓶倒转过来,观察瓶塞周围是否有水漏出即可 |
| A. | HCl→Cl2 | B. | MnO4→Mn2+ | C. | SO3→SO42- | D. | CO2→CO |
| A. | 向氯化亚铁溶液中通入氯气:Fe2++Cl2═Fe3++2Cl- | |
| B. | 将氯气通入冷的氢氧化钠溶液中:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | 氨气通入醋酸溶液CH3COOH+NH3═CH3COONH4 | |
| D. | 金属铝溶于盐酸中:Al+2H+═Al3++H2↑ |
| A. | 升高温度,促进CO32-水解,pH减小 | |
| B. | 离子浓度:c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] | |
| C. | 离子浓度:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| D. | 离子浓度:c(Na+)>c(CO32-)>c(OH-)>c(H+)>c(HCO3-) |
| A. | 高纯度的单晶硅可用于制造太阳能电池板和光导纤维 | |
| B. | 石油可以通过裂解、裂化等物理变化获得重要化工原料乙烯 | |
| C. | 鸡蛋清和淀粉溶液都属于胶体,遇到硫酸铜溶液可以发生胶体聚沉 | |
| D. | 植物油中由于含有碳碳双键,因此在空气中长时间放置容易氧化变质 |