题目内容
20.将下列物质加入或通入紫色石蕊溶液中,不能使其褪色的是( )| A. | SO2 | B. | Cl2 | C. | Na2O2 | D. | NaClO |
分析 A.二氧化硫不能漂白指示剂;
B.氯气与水反应生成次氯酸,具有漂白性;
C.过氧化钠具有强的氧化性,具有漂白性;
D.次氯酸钠具有强的氧化性,具有漂白性.
解答 解:A.二氧化硫通入紫色石蕊试液,与水反应生成亚硫酸,亚硫酸电离产生氢离子,溶液显酸性,颜色变红,故A选;
B.氯气通入紫色石蕊试液,与水反应生成盐酸和次氯酸,次氯酸具有漂白性,所以溶液最终变为无色,故B不选;
C.过氧化钠具有强的氧化性,具有漂白性,能够使石蕊溶液褪色,故C不选;
D.次氯酸钠具有强的氧化性,具有漂白性,能够使石蕊溶液褪色,故D不选;
故选:A.
点评 本题考查了常见漂白物质,熟悉二氧化硫、次氯酸钠、氯气、过氧化钠的性质是解题关键,注意对基础知识的积累.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案
相关题目
10.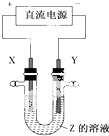 利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
 利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )| A. | 外加电流的阴极保护法中,Y是待保护金属 | |
| B. | 铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 | |
| C. | 电镀工业中,X是待镀金属,Y是镀层金属 | |
| D. | 氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠 |
11.物质A~E均含同种元素,都是中学化学中常见的物质,它们可发生如图所表示的反应.已知A是一种淡黄色的固体,B是银白色金属单质.
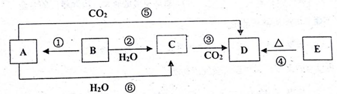
(1)反应⑤可用于潜水艇中制取氧气,相关的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,氧化剂是Na2O2,还原剂是Na2O2;
(2)根据反应②相关的现象,从表格下方找出相应性质序号填在表格中,并在对应的位置写上该反应的化学方程式.
与反应现象相应的性质:①反应后生成了酸性物质;②反应后生成了碱性物质;③单质B的熔点低;④单质B的密度比水的小;⑤生成了气体;⑥单质B的密度比水的密度大.
(3)D和E分别与等浓度的盐酸反应,相同条件下生成等体积的气体,则以下说法正确的是:①③(填序号)①消耗D的质量较多;②消耗E的质量较多;③D消耗盐酸的体积更大 ④E消耗盐酸的体积更大.

(1)反应⑤可用于潜水艇中制取氧气,相关的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,氧化剂是Na2O2,还原剂是Na2O2;
(2)根据反应②相关的现象,从表格下方找出相应性质序号填在表格中,并在对应的位置写上该反应的化学方程式.
| 现象 | 单质B的相关性质(填序号) | 相关的化学方程式 | |
| Ⅰ | 单质B浮在水面上 | ||
| Ⅱ | 熔成一个小球 | ||
| Ⅲ | 四处游动,发出嘶嘶的声音 | ||
| Ⅳ | 滴入酚酞试剂,溶液变红 |
(3)D和E分别与等浓度的盐酸反应,相同条件下生成等体积的气体,则以下说法正确的是:①③(填序号)①消耗D的质量较多;②消耗E的质量较多;③D消耗盐酸的体积更大 ④E消耗盐酸的体积更大.
8.在体积一定的密闭容器中,给定物质A、B、C的量,在一定条件下发生反应,建立如下化学平衡:aA(g)+bB(g)?xC(g),符合图(1)所示的关系(C%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强).在图(2)中,Y轴是指( )
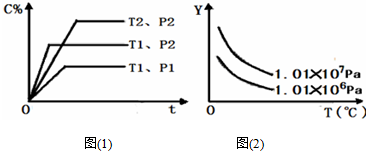

| A. | 反应物A的百分含量 | B. | 反应物B的平衡转化率 | ||
| C. | 平衡混合气的密度 | D. | 平衡混合气的总物质的量 |
15.下列各组中的反应(反应在溶液中进行),可用同一离子方程式表示的是( )
| A. | NaOH+HCl与KOH+CH3COOH | B. | NaOH+H2SO4与 Ba(OH)2+H2SO4 | ||
| C. | BaCl2+H2SO4与Ba(OH)2+Na2SO4 | D. | CaCO3+H2SO4 与Na2CO3+HCl |
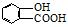 ⑤聚乙烯⑥
⑤聚乙烯⑥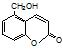 ,⑦丁子香酚
,⑦丁子香酚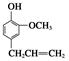
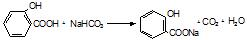 .
.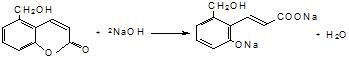 .
. 等.
等.
 2AB3(g),达到平衡时A2的转化率大小为:b>a>c
2AB3(g),达到平衡时A2的转化率大小为:b>a>c