题目内容
6.为了测定工业纯碱中Na2CO3的质量分数(含少量NaCl),甲、乙两位同学分别设计了一套实验方案.学生甲的实验流程如图所示:
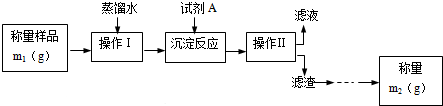
学生乙设计的实验步骤如下:
①称取样品,为1.150g;
②溶解后配成250mL溶液;
③取20mL上述溶液,加入甲基橙2~3滴;
④用0.1140mol/L的标准盐酸进行滴定;
⑤数据处理.
回答下列问题:
(1)甲同学设计的方案中试剂A可以选用ab(填编号)
a.CaCl2 b.BaCl2 c.AgNO3
(2)操作Ⅱ后还应对滤渣依次进行①洗涤、②烘干两个实验操作步骤.其中,证明前面一步的操作已经完成的方法是取最后一次洗涤液,加入AgNO3无沉淀证明洗涤干净;
(3)学生乙某次实验开始滴定时,盐酸溶液的刻度在0.00mL处,当滴至黄色至橙色,半分钟不褪色时达到滴定终点,此时盐酸溶液的刻度在14.90mL处,乙同学以该次实验数据计算此样品中Na2CO3的质量分数是0.98或97.85%(保留两位小数).乙同学的这次实验结果与老师给出的理论值非常接近,但老师最终认定他的实验方案设计不合格,你认为可能的原因是什么?没有做平行试验取平均值.
分析 (1)加入沉淀剂A后使碳酸根离子转化成沉淀,可以使用氯化钙、氯化钡溶液,不能使用硝酸银溶液;
(2)称量沉淀的质量前,需要除去沉淀表明的杂质、水,据此判断①②操作方法;洗涤液中若不含氯离子,可以证明已经洗涤干净;
(3)甲基橙的变色范围为3.1~4.4,滴定结束时溶液由黄色变为橙色;根据反应关系式及消耗盐酸的体积计算出样品中碳酸钠的质量分数;滴定操作中,为了减小误差,需要多次操作取平均值.
解答 解:(1)为了测定工业纯碱中Na2CO3的质量分数(含少量NaCl),加入沉淀剂后将碳酸根离子转化成沉淀,可以用CaCl2、BaCl2,由于硝酸银溶液能够与碳酸根离子、氯离子反应,所以不能使用硝酸银溶液,
故答案为:ab;
(2)称量沉淀的质量前,为了减小误差,需要对沉淀进行洗涤、烘干操作,从而除去沉淀中的氯化钠、水;检验沉淀已经洗涤干净的操作方法为:取最后一次洗涤液,加入AgNO3无沉淀证明洗涤干净,
故答案为:洗涤;烘干; 取最后一次洗涤液,加入AgNO3无沉淀证明洗涤干净;
(3)滴定结束前溶液显示碱性,为黄色,滴定结束时溶液变为橙色,则滴定终点的现象为:溶液由黄色变为橙色,且半分钟不褪色;
盐酸溶液的刻度在14.90mL处,消耗HCl的物质的量为:0.1140mol/L×0.01490L=0.0016986mol,根据关系式Na2CO3~2HCl可知,20mL该溶液中含有碳酸钠的物质的量为:0.0016986mol×$\frac{1}{2}$=0.0008493mol,则250mL溶液中含有的碳酸钠的物质的量为:0.0008493mol×$\frac{250mL}{20mL}$=0.01061625mol,所以样品中碳酸钠的质量分数为:$\frac{106g/mol×0.01061625mol}{1.150g}$×100%=97.85%或0.98;
滴定操作测量纯度时,为了减小误差,需要多次滴定取平均值,而乙同学没有没有做平行试验取平均值,所以设计的方案不合格,
故答案为:黄色至橙色,半分钟不褪色; 0.98或97.85%;没有做平行试验取平均值.
点评 本题考查了探究物质组成、测量物质含量的方法,题目难度中等,明确实验原理为解答关键,试题侧重考查学生的分析、理解能力及化学实验能力,注意掌握化学实验基本操作方法;(3)中碳酸钠的质量分数为易错点,注意正确保留有效数字.

| A. | 氧化铝可以与氢氧化钠溶液反应 | |
| B. | 向硅酸钠溶液中滴加适量稀盐酸,有透明的凝胶形成 | |
| C. | 氯气通入石蕊中先变红后褪色 | |
| D. | 向Fe2(SO4)3溶液中滴加NaOH溶液,生成红褐色沉淀 |
| A. | 分子式C7H16的烃,分子中有4个甲基的同分异构体有4种(不考虑立体异构) | |
| B. | 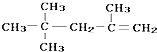 的名称为:2,2,4-三甲基-4-戊烯 的名称为:2,2,4-三甲基-4-戊烯 | |
| C. | 化合物 是苯的同系物 是苯的同系物 | |
| D. | 苯和溴水在三溴化铁做催化剂的条件下发生取代反应 |
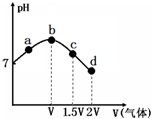 常温常压下,将NH3缓慢通入饱和食盐水中至饱和,然后向所得溶液中缓慢通入CO2,整个实验进程中溶液的pH随通入气体体积的变化曲线如图所示(实验中不考虑氨水的挥发).下列叙述不正确的是( )
常温常压下,将NH3缓慢通入饱和食盐水中至饱和,然后向所得溶液中缓慢通入CO2,整个实验进程中溶液的pH随通入气体体积的变化曲线如图所示(实验中不考虑氨水的挥发).下列叙述不正确的是( )| A. | 由a点到b点的过程中,溶液中$\frac{{c(N{H_3}•{H_2}O)}}{c(NH_4^+)}$增大 | |
| B. | 由图可知(NH4)2CO3溶液显碱性、NH4Cl溶液显酸性 | |
| C. | c点所示溶液中,c(NH4+)>c(CO32-)>c(OH-)>c(H+) | |
| D. | d点所示溶液中,c(NH4+)+c(NH3•H2O)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| A. | NaClO溶液 | B. | 干燥的氯气 | C. | 氯水 | D. | 次氯酸钙溶液 |
| A. |  根据图可判断可逆反应A2(g)+3B2(g)?2AB3(g),正反应是吸热反应 | |
| B. | 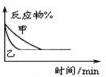 如图表示压强对反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 | |
| C. | 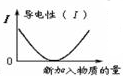 图可表示乙酸溶液中通入氨气至过量的过程中溶液导电性的变化 | |
| D. | 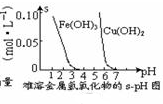 根据图可知,若除去CuSO4溶液中的Fe3+,可向溶液中加入CuO,调节pH在4~5之间即可 |
 (1)铝热反应在工业生产中的重要用途之一是焊接钢轨或冶炼难熔金属等;用化学方程式表示出其中的原理2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe(举一例).铝制品因为表面易形成致密的氧化铝薄膜而经久耐用,但是该氧化膜易被酸、碱破坏,若将表面有一层氧化铝薄膜的铝条和氢氧化钠溶液作用,反应的化学方程式为Al2O3+2NaOH═2NaAlO2+H2O、2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(1)铝热反应在工业生产中的重要用途之一是焊接钢轨或冶炼难熔金属等;用化学方程式表示出其中的原理2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe(举一例).铝制品因为表面易形成致密的氧化铝薄膜而经久耐用,但是该氧化膜易被酸、碱破坏,若将表面有一层氧化铝薄膜的铝条和氢氧化钠溶液作用,反应的化学方程式为Al2O3+2NaOH═2NaAlO2+H2O、2Al+2NaOH+2H2O=2NaAlO2+3H2↑.