题目内容
14. (1)铝热反应在工业生产中的重要用途之一是焊接钢轨或冶炼难熔金属等;用化学方程式表示出其中的原理2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe(举一例).铝制品因为表面易形成致密的氧化铝薄膜而经久耐用,但是该氧化膜易被酸、碱破坏,若将表面有一层氧化铝薄膜的铝条和氢氧化钠溶液作用,反应的化学方程式为Al2O3+2NaOH═2NaAlO2+H2O、2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
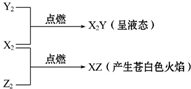
(1)铝热反应在工业生产中的重要用途之一是焊接钢轨或冶炼难熔金属等;用化学方程式表示出其中的原理2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe(举一例).铝制品因为表面易形成致密的氧化铝薄膜而经久耐用,但是该氧化膜易被酸、碱破坏,若将表面有一层氧化铝薄膜的铝条和氢氧化钠溶液作用,反应的化学方程式为Al2O3+2NaOH═2NaAlO2+H2O、2Al+2NaOH+2H2O=2NaAlO2+3H2↑.(2)常温、常压下X2、Y2、Z2三种气体有如图转化关系:
①三种气体的化学式分别是X2:H2、Y2:O2、Z2:Cl2.
②Z2与X2Y能发生反应,该反应是氧化还原反应(填“是”或“不是”).
③Z2与NaOH溶液反应的离子方程式为Cl2+2OH=Cl-+ClO-+H2O.
分析 (1)铝热反应中放出大量的热,可冶炼难熔金属等,如Al与氧化铁反应生成氧化铝和Fe;氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水;
(2)根据转化关系,X2、Z2点燃火焰呈苍白色,应为氢气在氯气中燃烧,X2、Y2、点燃生成液态物质,且X、Y原子个数比为2:1,可知X2Y为水,所以X2 为H2,Y2为O2,Z2为Cl2,据此答题.
解答 解:(1)铝热反应中放出大量的热,可用来焊接钢轨或冶炼难熔金属等,如Al与氧化铁反应生成氧化铝和Fe,该反应为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,该离子反应为Al2O3+2NaOH═2NaAlO2+H2O,铝与氢氧化钠反应生成偏铝酸钠和氢气,反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:焊接钢轨或冶炼难熔金属等;2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;Al2O3+2NaOH═2NaAlO2+H2O;2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(2)根据转化关系,X2、Z2点燃火焰呈苍白色,应为氢气在氯气中燃烧,X2、Y2、点燃生成液态物质,且X、Y原子个数比为2:1,可知X2Y为水,所以X2 为H2,Y2为O2,Z2为Cl2,
(1)根据上面的分析可知,X2、Y2、Z2分别是H2、O2、Cl2,
故答案为:H2、O2、Cl2;
(2)氯气与水反应生成氯化氢和次氯酸钠,反应的化学方程式为Cl2+H2?HCl+HClO,是氧化还原反应,
故答案为:是;
(3)氯气与NaOH溶液反应生成氯化钠和次氯酸钠,反应的离子方程式为Cl2+2OH=Cl-+ClO-+H2O,
故答案为:Cl2+2OH=Cl-+ClO-+H2O.
点评 本题主要考查是H2、O2、Cl2 的性质,内容比较简单,注重基础知识的考查,答题时注意根据反应现象和物质的组成、状态等进行推断,注意化学用语的正确表达.

| A. | 有2nmol(NH4)2SO4分解 | B. | 有$\frac{n}{2}$molS原子被氧化 | ||
| C. | 生成$\frac{n}{6}$mol氧化产物 | D. | 生成7nmolH2O |
| A. | 硅胶常用作袋装食品的干燥剂,也可用作催化剂的载体 | |
| B. | 过渡元素金属作半导体材料 | |
| C. | 考古时利用14C测定一些文物的年代 | |
| D. | 纯净的SiO2是现代光学及光纤制品的基本原料 |
| A. | 28gCO与N2的混合物中含有的分子总数为NA | |
| B. | 常温、常压下,22.4LO2中含有的O2分子数为NA | |
| C. | 1L1mol•L-1K2SO4溶液中含有的钾离子数为2NA | |
| D. | 过量的铁1molCl2充分反应时,铁失去的电子数为2NA |
| A. | 标准状况下,22.4LO2中一定含有NA个氧原子 | |
| B. | 将80gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为2mol/L | |
| C. | 标准状况下,NA个H2O分子的体积是22.4L | |
| D. | 3.4gNH3含有的分子数为0.2NA |
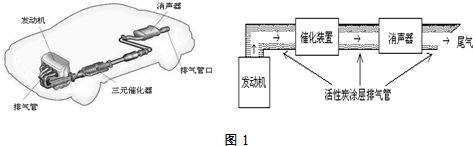
(1)汽车发动机工作时会引发N2(g)+O2(g)=2NO(g)△H=+180kJ•mol-1,其能量变化示意图如下:
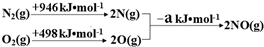
则NO中氮氧键的键能为632kJ•mol-1.
(2)空燃比过小易产生CO.有人提出可以设计反应2CO(g)=2C(s)+O2(g)来消除CO的污染.判断该设想是否可行,并说出理由不合理,该反应焓增、熵减,任何条件下都不能自发进行或该反应△H>0,△S<0则△G>0.
(3)利用活性炭涂层排气管处理NOx的反应为:xC(s)+2NOx(g)?N2(g)+xCO2 (g)△H=-b kJ•mol-1.若使NOx更加有效的转化为无毒尾气排放,以下措施理论上可行的是AD.
A.增加排气管长度 B.增大尾气排放口
C.升高排气管温度 D.添加合适的催化剂
(4)催化装置中涉及的反应之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).
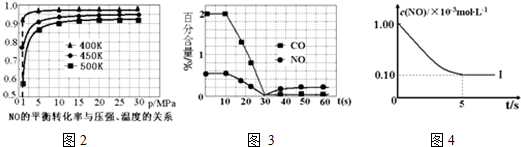
①探究上述反应中NO的平衡转化率与压强、温度的关系,得到图2所示的曲线.催化装置比较适合的温度和压强是400K,1MPa.
②测试某型号汽车在冷启动(冷启动指发动机水温低的情况下启动)时催化装置内CO和NO百分含量随时间变化曲线如图3所示.则前10s 内,CO和NO百分含量没明显变化的原因是尚未达到催化剂工作温度(或尚未达到反应的温度).
③研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了以下三组实验:
| 实验编号 | T(K) | NO初始浓度 (mol•L-1) | CO初始浓度 (mol•L-1) | 催化剂的比表面积(m2/g) |
| Ⅰ | 400 | 1.00×10-3 | 3.60×10-3 | 82 |
| Ⅱ | 400 | 1.00×10-3 | 3.60×10-3 | 124 |
| Ⅲ | 450 | 1.00×10-3 | 3.60×10-3 | 124 |
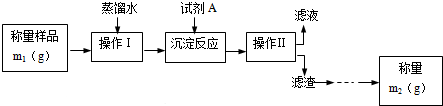
 按要求完成下列问题:
按要求完成下列问题: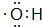 ;
;