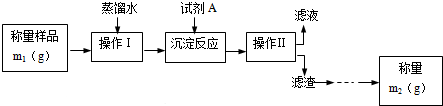
题目内容
11.将干净的铁片浸在熔化的液体锌里可制得热镀锌铁板,这种铁板具有很强的耐腐蚀能力.镀锌铁板的镀锌层一旦被破坏后,锌将作为原电池的负极,发生氧化反应(填“氧化”或“还原”)而损耗,铁受到保护.分析 在原电池中,活泼金属做负极,发生失电子的氧化反应,由此分析解答.
解答 解:镀锌铁板的镀锌层一旦被破坏后,较活泼金属锌将作为原电池的负即,发生失电子的氧化反应,故答案为:负;氧化.
点评 本题考查了原电池和电化学的原理,属于综合知识的考查,题目难度中等,注意掌握原电池工作原理.

练习册系列答案
相关题目
2.下列有关物质用途的说法中,错误的是( )
| A. | 硅胶常用作袋装食品的干燥剂,也可用作催化剂的载体 | |
| B. | 过渡元素金属作半导体材料 | |
| C. | 考古时利用14C测定一些文物的年代 | |
| D. | 纯净的SiO2是现代光学及光纤制品的基本原料 |
19.用NA表示阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,22.4LO2中一定含有NA个氧原子 | |
| B. | 将80gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为2mol/L | |
| C. | 标准状况下,NA个H2O分子的体积是22.4L | |
| D. | 3.4gNH3含有的分子数为0.2NA |
16.下列说法正确的是( )
| A. | 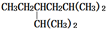 的系统命名法为2,5-二甲基-4-乙基己烷 的系统命名法为2,5-二甲基-4-乙基己烷 | |
| B. | 石油的裂化、煤的气化与液化都属于化学变化,而石油的分馏与煤的干馏都属于物理变化 | |
| C. | 总质量一定时,乙酸和葡萄糖无论以何种比例混合,完全燃烧消耗氧气的量相等 | |
| D. | 油脂、淀粉、蛋白质等高分子化合物都属于混合物,一定条件下均可发生水解 |
3.汽车尾气排放的一氧化碳、氮氧化物等气体已成为大气污染的主要来源.德国大众汽车尾气检测造假事件引起全世界震惊.根据下列示意图(如图1)回答有关问题:
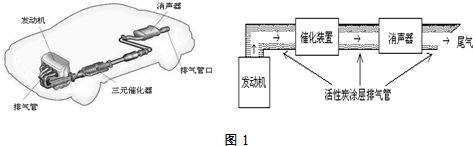
(1)汽车发动机工作时会引发N2(g)+O2(g)=2NO(g)△H=+180kJ•mol-1,其能量变化示意图如下:
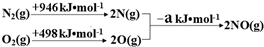
则NO中氮氧键的键能为632kJ•mol-1.
(2)空燃比过小易产生CO.有人提出可以设计反应2CO(g)=2C(s)+O2(g)来消除CO的污染.判断该设想是否可行,并说出理由不合理,该反应焓增、熵减,任何条件下都不能自发进行或该反应△H>0,△S<0则△G>0.
(3)利用活性炭涂层排气管处理NOx的反应为:xC(s)+2NOx(g)?N2(g)+xCO2 (g)△H=-b kJ•mol-1.若使NOx更加有效的转化为无毒尾气排放,以下措施理论上可行的是AD.
A.增加排气管长度 B.增大尾气排放口
C.升高排气管温度 D.添加合适的催化剂
(4)催化装置中涉及的反应之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).
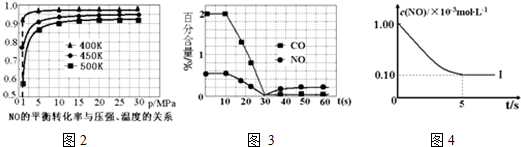
①探究上述反应中NO的平衡转化率与压强、温度的关系,得到图2所示的曲线.催化装置比较适合的温度和压强是400K,1MPa.
②测试某型号汽车在冷启动(冷启动指发动机水温低的情况下启动)时催化装置内CO和NO百分含量随时间变化曲线如图3所示.则前10s 内,CO和NO百分含量没明显变化的原因是尚未达到催化剂工作温度(或尚未达到反应的温度).
③研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了以下三组实验:
根据坐标图4,计算400K时该反应的平衡常数为5000L•mol-1;并在图中画出上表中的实验Ⅱ、Ⅲ条件下混合气体中NO浓度随时间变化的趋势曲线图(标明各条曲线的实验编号).

(1)汽车发动机工作时会引发N2(g)+O2(g)=2NO(g)△H=+180kJ•mol-1,其能量变化示意图如下:

则NO中氮氧键的键能为632kJ•mol-1.
(2)空燃比过小易产生CO.有人提出可以设计反应2CO(g)=2C(s)+O2(g)来消除CO的污染.判断该设想是否可行,并说出理由不合理,该反应焓增、熵减,任何条件下都不能自发进行或该反应△H>0,△S<0则△G>0.
(3)利用活性炭涂层排气管处理NOx的反应为:xC(s)+2NOx(g)?N2(g)+xCO2 (g)△H=-b kJ•mol-1.若使NOx更加有效的转化为无毒尾气排放,以下措施理论上可行的是AD.
A.增加排气管长度 B.增大尾气排放口
C.升高排气管温度 D.添加合适的催化剂
(4)催化装置中涉及的反应之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).

①探究上述反应中NO的平衡转化率与压强、温度的关系,得到图2所示的曲线.催化装置比较适合的温度和压强是400K,1MPa.
②测试某型号汽车在冷启动(冷启动指发动机水温低的情况下启动)时催化装置内CO和NO百分含量随时间变化曲线如图3所示.则前10s 内,CO和NO百分含量没明显变化的原因是尚未达到催化剂工作温度(或尚未达到反应的温度).
③研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了以下三组实验:
| 实验编号 | T(K) | NO初始浓度 (mol•L-1) | CO初始浓度 (mol•L-1) | 催化剂的比表面积(m2/g) |
| Ⅰ | 400 | 1.00×10-3 | 3.60×10-3 | 82 |
| Ⅱ | 400 | 1.00×10-3 | 3.60×10-3 | 124 |
| Ⅲ | 450 | 1.00×10-3 | 3.60×10-3 | 124 |
20.m mol C2H2跟n mol H2发生加成反应,当其达到平衡时,生成p mol C2H4.将平衡的混合气体完全燃烧后生成二氧化碳和水,所需氧气的物质的量是多少摩尔( )
| A. | 3m+n | B. | $\frac{5}{2}$m+$\frac{1}{2}$n-p | C. | $\frac{5}{2}$m+$\frac{1}{2}$n | D. | 3m+n+2p |
7.已知:FeO(s)+CO(g)?Fe(s)+CO2(g)△H>0
①该反应的平衡常数表达式:K=$\frac{c(C{O}_{2})}{c(CO)}$.
②其平衡常数K与温度T的关系如表:
试判断K1<K2(填写“>”,“=”或“<”).
③若该反应在恒温恒容条件下进行,能说明该反应已达到平衡状态的是bc (填字母).
a.容器内CO2与CO的浓度之比为1:1
b.v(CO2)正=v(CO)逆
c.混合气体的密度保持不变
d.容器内压强保持不变.
①该反应的平衡常数表达式:K=$\frac{c(C{O}_{2})}{c(CO)}$.
②其平衡常数K与温度T的关系如表:
| T/K | 298 | 398 |
| 平衡常数K | K1 | K2 |
③若该反应在恒温恒容条件下进行,能说明该反应已达到平衡状态的是bc (填字母).
a.容器内CO2与CO的浓度之比为1:1
b.v(CO2)正=v(CO)逆
c.混合气体的密度保持不变
d.容器内压强保持不变.
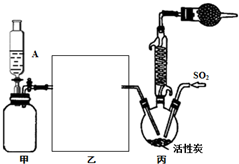 硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如图所示:
硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如图所示: