题目内容
20.反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量加了0.45mol,则此反应的平均速率v(X)(反应物的消耗速率或产物的生成速率)可表示为( )| A. | v(NO)=0.0010mol•L-1•s-1 | B. | v(O2)=0.0010mol•L-1•s-1 | ||
| C. | v(NH3)=0.0100mol•L-1•s-1 | D. | v(H2O)=0.045mol•L-1•s-1 |
分析 在10L密闭容器中进行,半分钟后,水蒸气的物质的量加了0.45mol,则v(H2O)=$\frac{\frac{0.45mol}{10L}}{30s}$=0.015mol•L-1•s-1,结合反应速率之比等于化学计量数之比计算,以此来解答.
解答 解:在10L密闭容器中进行,半分钟后,水蒸气的物质的量加了0.45mol,则v(H2O)=$\frac{\frac{0.45mol}{10L}}{30s}$=0.0015mol•L-1•s-1,
由反应速率之比等于化学计量数之比可知,
v(NH3)=v(NO)=0.0015mol•L-1•s-1×$\frac{4}{6}$=0.0010mol•L-1•s-1,
v(O2)=0.0015mol•L-1•s-1×$\frac{5}{6}$=0.00125mol•L-1•s-1,
故选A.
点评 本题考查化学反应速率,为高频考点,把握反应速率的计算公式及反应速率与化学计量数的关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
10.已知异丙苯的结构简式如图,下列说法错误的是( )
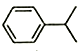

| A. | 异丙苯的分子式为C9H12 | |
| B. | 异丙苯能使酸性高锰酸钾溶液褪色 | |
| C. | 异丙苯中碳原子可能都处于同一平面 | |
| D. | 异丙苯的和苯为同系物 |
11.瑞香素具有消炎杀菌作用,结构如图所示,下列叙述正确的是( )
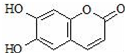

| A. | 与稀H2SO4混合加热不反应 | |
| B. | 不能使酸性高锰酸钾溶液褪色 | |
| C. | 1mol 瑞香素最多能与3mol Br2发生反应 | |
| D. | 1mol瑞香素与足量的NaOH溶液发生反应时,消耗NaOH 2mol |
8.某溶液中可能含有Na+、Mg2+、Fe2+、H+、OH-、NO3-等几种离子中的若干种,向该溶液中加入氧化铝后,溶液中有X离子生成,下列判断中正确的是( )
| A. | 溶液中可以同时含有Fe2+、NO3- | B. | 溶液中一定有OH-、Na+ | ||
| C. | 溶液中可能含有Na+、H+、Mg2+、NO3- | D. | 若X是AlO2-,则上述离子最多有2种 |
15.与CH2═CH2→CH2Br-CH2Br的变化属于同一反应类型的是( )
| A. | CH≡CH→CH2═CHCN | B. | C2H5Cl→CH2═CH2 | ||
| C. | C6H6→C6H6-NO2 | D. | CH3COOH→CH3COOC2H5 |
12.某溶液中有Fe3+、Mg2+、Fe2+和Al3+四种阳离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子组合是( )
| A. | Mg2+ | B. | Mg2+、Fe2+ | C. | Fe2+ | D. | Mg2+、Al3+ |
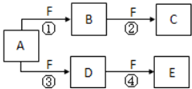 X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示:
X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示: .
.
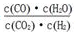 。恒容时,温度升高,H2浓度减小,下列说法正确的是
。恒容时,温度升高,H2浓度减小,下列说法正确的是 CO2+H2
CO2+H2