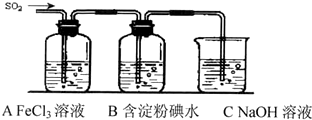
��Ŀ����
3�� һ�������£������ܱ������з�����Ӧ2NO��g��?N2��g��+O2��g����ͼ�У�����a��ʾ�÷�Ӧ��T�¶���NO��Ũ����ʱ��ı仯������b��ʾ�÷�Ӧ��ijһ��ʼ�����ı�ʱN2��Ũ����ʱ��ı仯������������ȷ���ǣ�������
һ�������£������ܱ������з�����Ӧ2NO��g��?N2��g��+O2��g����ͼ�У�����a��ʾ�÷�Ӧ��T�¶���NO��Ũ����ʱ��ı仯������b��ʾ�÷�Ӧ��ijһ��ʼ�����ı�ʱN2��Ũ����ʱ��ı仯������������ȷ���ǣ�������| A�� | T�¶��£��÷�Ӧ��ƽ�ⳣ��K=$\frac{4��{c}_{0}-{c}_{1}��^{2}}{{{c}_{1}}^{2}}$ | |
| B�� | T�¶��£����ŷ�Ӧ�Ľ��У����������ܶȼ�С | |
| C�� | ����b��Ӧ�������ı�����Ǽ����˴��� | |
| D�� | ������b��Ӧ�������ı����¶ȣ����жϸ÷�Ӧ�ġ�H��0 |
���� A����ͼ��֪������Ũ�ȱ仯������ƽ��Ũ�ȼ���ƽ�ⳣ����
B��������Ϊ�����ܱ���������=$\frac{m}{V}$���ݴ��жϼ��ɣ�
C������ֻ�ܸı仯ѧ��Ӧɫ���ʣ����ܸı����ʵ�ת���ɣ�
D����ͼ��֪��b����ѧ��Ӧ���ʿ죬���������¶ȣ�������ƽ��Ũ�ȼ�С��������ӦΪ���ȷ�Ӧ��
��� �⣺A.2NO��g��?N2��g��+O2��g����
��mol/L�� c0 0 0
ת��mol/L�� ��c0 -c1 �� $\frac{1}{2}$��c0 -c1 �� $\frac{1}{2}$��c0 -c1 ��
ƽ��mol/L�� c1$\frac{1}{2}$��c0 -c1 �� $\frac{1}{2}$��c0 -c1 ��
��K=$\frac{��{c}_{0}-{c}_{1}��^{2}}{4{{c}_{1}}^{2}}$����A����
B����Ӧ���������������壬�����������m���䣬����Ϊ������������V���䣬���ܶȦ�=$\frac{m}{V}$���䣬��B����
C����ͼ��֪��b���ߵ�����ƽ��Ũ�ȼ�С����Ӧ��ƽ�ⷢ���ƶ�������ֻ�ܸı����ʣ����ܸı�ƽ�⣬��b���߲����������ڴ���Ӱ��ģ���C����
D����ͼ��֪��b����ѧ��Ӧ���ʿ죨�仯���ȴ�������ƽ��Ũ�ȼ�С�������¶�ƽ�������ƶ���������ӦΪ���ȷ�Ӧ������H��0����D��ȷ��
��ѡD��
���� ���⿼�����ʵ���Ũ����ʱ��仯���ߣ�Ϊ��Ƶ���㣬���ջ�ѧƽ����㡢��ѧƽ���ƶ�Ӱ�����ص�Ϊ���Ĺؼ������ط�����Ӧ�������Ŀ��飬��Ŀ�ѶȲ���

 ��ѧ����ϵ�д�
��ѧ����ϵ�д�| A�� | ͬһԪ�ز����ܼȱ��ֽ����ԣ��ֱ��ַǽ����� | |
| B�� | ��������Ԫ�ص���������ϼ۵������������������� | |
| C�� | ������Ԫ���γ����Ӻ��������Ӷ��ﵽ2���ӻ�8�����ȶ��ṹ | |
| D�� | ͬһ�����Ԫ�ص�ԭ�ӣ�������������ͬ����ѧ������ȫ��ͬ |
| A�� | ���³�ѹ�£�4.4g�����Ϊ3��1��CO2��N2O��ɵĻ������������ԭ������Ϊ0.3NA | |
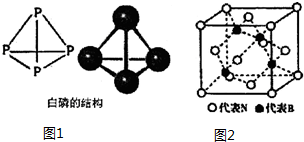
| B�� | CH4��P4�ķ��ӽṹ��Ϊ���������Σ���1molCH4��P4�����к��й��ۼ�����Ϊ4NA | |
| C�� | ����NA�������ӵ�Na2O����ˮ�γ�1L����Һ�У����ʵ��������Ũ��Ϊ1mol•L-1 | |
| D�� | ��״���£�5.6L18O2�μӷ�Ӧһ��ת��NA��e- |
| Cu��OH��2 | Mg��OH��2 | Fe��OH��3 | Al��OH��3 | |
| ��ʼ������pH | 4.8 | 9.3 | 2.7 | 3.8 |
| ��ȫ������pH | 6.4 | 10.8 | 3.7 | 4.7 |

��ش��������⣺
��1�����������Ҫ��;�ǵ��ߵȣ���һ�ּ��ɣ���������е���pH��ΧΪ3.7-9.3��
��2������Һ������Ӧ�ɵõ���Ҫ�Ʊ���һ�ֽ������������Һ������Ҫͨ������Ļ�ѧʽCO2����Ӧ�Ļ�ѧ����ʽΪNaAlO2+CO2+H2O�TNaHCO3+Al��OH��3��2Al��OH��3$\frac{\underline{\;����\;}}{\;}$Al2O3+3H2O��
��3��д������Һ��õ���Һ������ӷ���ʽAl3++4OH-�TAlO2-+2H2O��
��4����Һ���к��еĽ�����������Mg2+��
��5����ҵ�ϣ�ұ����������ͭ��þ�ķ���������B������ţ���
A����ⷨ���Ȼ�ԭ�����ֽⷨ���ֽⷨ B����ⷨ���Ȼ�ԭ�����Ȼ�ԭ������ⷨ
C���Ȼ�ԭ�����ֽⷨ����ⷨ����ⷨ D���Ȼ�ԭ�����Ȼ�ԭ�����Ȼ�ԭ������ⷨ
�ڹ�ҵ�����У�ұ����Щ����ʱѡ�����Ӧ���ʵĻ�ѧʽ������Al2O3��Fe2O3��CuO��MgCl2��
CO2��g��+H2��g��?CO��g��+H2O��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
| t�� | 600 | 800 | 830 | 1000 | 1200 |
| K | 0.25 | 0.9 | 1.0 | 1.7 | 2.6 |
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK=$\frac{c��CO��•c��{H}_{2}O��}{c��C{O}_{2}��•c��{H}_{2}��}$��
��2���÷�ӦΪ���ȷ�Ӧ��ѡ����ȡ��������ȡ�������Ӧ��ƽ�������ͨ��һ����CO2����ƽ�ⳣ��K�����䣬CO2��ת���ʼ�С�������������С�����䡱��
��3�����жϸ÷�Ӧ�Ƿ�ﵽ��ѧƽ��״̬��������bc����ѡ�۷֣���
a��������ѹǿ���� b����������� c��CO������
c��v����H2��=v�棨H2O�� d��c��CO2��=c��CO��
��4���� 600��ʱ���������г���1mol CO��1mol H2O����Ӧ�ﵽƽ���CO��ת������$\frac{2}{3}$��
| A�� | �����ص�������Ӧ�������������ʴ������Ӧ���� | |
| B�� | ÿת��1mol���������ֵ�ز�������Ϊ0.5�ȵ� | |
| C�� | ��صĸ�����ӦΪ��CH4+10OH-�TCO32-+7H2O+8e- | |
| D�� | ������0.4molȼ��ʱ������еĸ������ӵ�Ũ�ȹ�ϵΪ��C��K+����C��HCO3-����C��CO32-����C��OH-����C��H+�� |
| A�� | �������Z��ij���⻯�ﷴӦ����ǿ�� | |
| B�� | ����������һ��ֻ�����ۼ� | |
| C�� | W��ZԪ���γɵĻ�������ֻ�����Լ� | |
| D�� | X�ֱ���Y��Z��M��W�γɵij����������У��ȶ�����õ���XM |