题目内容
6.下列A、B、C、D是中学常见的混合物分离或提纯的基本装置.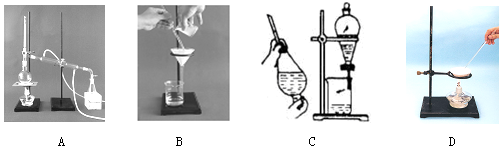
请根据混合物分离或提纯原理,回答在下列实验中需要使用哪种装置.将A、B、C、D填入适当的空格中.
(1)除去Ca(OH)2溶液中悬浮的CaCO3B
(2)从碘水中提取碘C
(3)用自来水制取蒸馏水A
(4)分离植物油和水C
(5)与海水晒盐原理相符的是D.
分析 (1)CaCO3不溶于水;
(2)碘不易溶于水,易溶于有机溶剂;
(3)自来水中水的沸点低;
(4)植物油和水分层;
(5)海水中水的沸点低,盐的沸点高.
解答 解:由装置可知,A为蒸馏装置、B为过滤装置,C为分液、萃取,D为蒸发装置,
(1)CaCO3不溶于水,则选择过滤法分离,故答案为:B;
(2)碘不易溶于水,易溶于有机溶剂,则选择萃取、分液分离,故答案为:C;
(3)水的沸点低,则选择蒸馏法制备蒸馏水,故答案为:A;
(4)植物油和水分层,选择分液法分离,故答案为:C;
(4)海水中水的沸点低,盐的沸点高,与蒸发原理相同,故答案为:D.
点评 本题考查混合物分离提纯,为高频考点,把握实验装置的作用、混合物分离提纯为解答的关键,侧重分析与实验能力的考查,注意分离方法的选择,题目难度不大.

练习册系列答案
相关题目
17.已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol
Na2O2(s)+CO2(g)═Na2CO3(s)+21O2(g)△H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
Na2O2(s)+CO2(g)═Na2CO3(s)+21O2(g)△H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
| A. | CO的燃烧热为283kJ | |
| B. | 25℃、101 kPa时,1 mol CO和2 mol CO的燃烧热相等 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H<-452 kJ/mol | |
| D. | CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023 |
14.在某温度时,测得纯水中的c(H+)=2.0×10-7mol•L-1,则c(OH-)为( )
| A. | 2.0×10-7mol•L-1 | B. | 0.1×10-7mol•L-1 | C. | 5.0×10-6mol•L-1 | D. | 无法确定 |
11.X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:
①X元素原子价电子排布式为ns2np2,且原子半径是同族元素中最小的.
②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有1个未成对电子.
③Z元素的电离能数据见表(kJ/mol):
请回答:
(1)Z2Y2的电子式为 ,含有的化学键类型离子键和共价键,Z2Y2为离子晶体.
,含有的化学键类型离子键和共价键,Z2Y2为离子晶体.
(2)X、Y、Z三种元素所形成的常见化合物的名称为碳酸钠;XY2的结构式为O=C=O,分子立体构型为直线形.
(3)X、Y、Z、W四种元素所形成的单质中,熔点最高、硬度最大的是金刚石(填名称);晶体ZW的熔点比晶体XW4明显高的原因是NaCl为离子晶体,CCl4为分子晶体,离子晶体熔点比分子晶体高.
①X元素原子价电子排布式为ns2np2,且原子半径是同族元素中最小的.
②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有1个未成对电子.
③Z元素的电离能数据见表(kJ/mol):
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
(1)Z2Y2的电子式为
 ,含有的化学键类型离子键和共价键,Z2Y2为离子晶体.
,含有的化学键类型离子键和共价键,Z2Y2为离子晶体.(2)X、Y、Z三种元素所形成的常见化合物的名称为碳酸钠;XY2的结构式为O=C=O,分子立体构型为直线形.
(3)X、Y、Z、W四种元素所形成的单质中,熔点最高、硬度最大的是金刚石(填名称);晶体ZW的熔点比晶体XW4明显高的原因是NaCl为离子晶体,CCl4为分子晶体,离子晶体熔点比分子晶体高.
15.下列生活中的化学小实验不合理的是( )
| A. | 用84消毒液除去地砖上的有色物质 | |
| B. | 用米汤检验加碘盐中的碘酸钾(KIO3) | |
| C. | 用纯碱(Na2CO3)溶液洗涤沾有油污的器具 | |
| D. | 利用燃烧的方法鉴别蚕丝和棉花 |
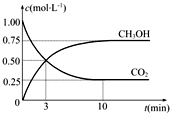 “低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题:
“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题: