题目内容
13.常温下,由水电离的c(H+)=1×10-13mol/L的溶液中一定不可能大量存在的离子是( )| A. | NH4+ | B. | HSO3- | C. | AlO2- | D. | Fe3+ |
分析 常温下,由水电离的c(H+)=1×10-13mol/L的溶液呈酸性或碱性,溶液中存在大量氢离子或氢氧根离子,
A.铵根离子不与氢离子反应,在酸性溶液中能够共存;
B.亚硫酸氢根离子与氢离子、氢氧根离子反应;
C.偏铝酸根离子不与氢氧根离子反应;
D.铁离子不与氢离子反应.
解答 解:常温下,由水电离的c(H+)=1×10-13mol/L的溶液呈酸性或碱性,溶液中存在大量氢离子或氢氧根离子
A.NH4+不与氢离子反应,在酸性溶液中能够共存,故A错误;
B.HSO3-与氢离子和氢氧根离子反应,在溶液中一定不能大量共存,故B正确;
C.AlO2-不与氢氧根离子反应,在酸碱性溶液中能够大量共存,故C错误;
D.Fe3+不与氢离子反应,在酸性溶液中能够大量共存,故D错误;
故选B.
点评 本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-.

练习册系列答案
相关题目
4.元素X、Y、Z位于相同短周期,它们的最高及最低化合价如表所示,下列判断错误的是( )
| 元素 | X | Y | Z |
| 最高、最低化合价 | +7 -1 | +6 -2 | +5 -3 |
| A. | 原子序数:X>Y>Z | B. | 原子半径:X>Y>Z | ||
| C. | 稳定性:HX>H2Y>ZH3 | D. | 酸性由强到弱:HXO4>H2YO4>H3ZO4 |
1.化合物X是一种医药中间体,其结构简式如图所示.下列有关化合物X的说法正确的是( )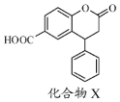

| A. | 分子中两个苯环一定处于同一平面 | |
| B. | 不能与饱和Na2CO3溶液反应 | |
| C. | 1 mol化合物X最多能与2 molNaOH反应 | |
| D. | 在酸性条件下水解,水解产物只有一种 |
8.化学式能表示物质分子组成的是( )
| A. | C6H6 | B. | SiO2 | C. | NaOH | D. | NH4Cl |
18.室温下,pH=4的盐酸和pH=10的氨水等体积混合后,所得溶液的pH值( )
| A. | 一定大于7 | B. | 一定等于7 | C. | 一定小于7 | D. | 可能大于7 |
2.等体积等物质的量浓度的NaHCO3溶液和Ba(OH)2溶液混合,离子方程式正确的是( )
| A. | CO32-+Ba2+→BaCO3↓ | |
| B. | HCO3-+OH-→H2O+CO32- | |
| C. | HCO3-+Ba2++OH-=H2O+BaCO3↓ | |
| D. | 2HCO3-+Ba2++2OH-→BaCO3↓+2H2O+CO32- |
3.下表中,对陈述I、II的正确性及两者间是否具有因果关系的判断都正确的是( )
| 选项 | 陈述I | 陈述II | 判断 |
| A | 氢氧化铝可用于治疗胃酸过多 | Al(OH)3可与盐酸反应 | I对,II对,有 |
| B | SiO2可用作光导纤维 | SO2是良好的半导体 | I对,II对,有 |
| C | Al2O3作耐火材料 | Al2O3具有高熔点 | I对,II错,无 |
| D | HF可用来蚀刻玻璃 | HF是强酸 | I对,II对,无 |
| A. | A | B. | B | C. | C | D. | D |