题目内容
2.等体积等物质的量浓度的NaHCO3溶液和Ba(OH)2溶液混合,离子方程式正确的是( )| A. | CO32-+Ba2+→BaCO3↓ | |
| B. | HCO3-+OH-→H2O+CO32- | |
| C. | HCO3-+Ba2++OH-=H2O+BaCO3↓ | |
| D. | 2HCO3-+Ba2++2OH-→BaCO3↓+2H2O+CO32- |
分析 等体积等物质的量浓度的NaHCO3溶液和Ba(OH)2溶液混合,碳酸氢钠完全反应,生成碳酸钡、水、NaOH,以此来解答.
解答 解:等体积等物质的量浓度的NaHCO3溶液和Ba(OH)2溶液混合,物质的量相同,碳酸氢钠完全反应,生成碳酸钡、水、NaOH,离子反应为HCO3-+Ba2++OH-=H2O+BaCO3↓,
故选C.
点评 本题考查离子反应方程式的书写,为高频考点,把握与量有关的离子反应、离子反应的书写方法为解答本题的关键,侧重分析与应用的考查,注意碳酸氢钠完全反应,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.常温下,由水电离的c(H+)=1×10-13mol/L的溶液中一定不可能大量存在的离子是( )
| A. | NH4+ | B. | HSO3- | C. | AlO2- | D. | Fe3+ |
10.下列有机物命名正确的是( )
| A. | 2-乙基戊烷 | B. | 1-甲基丙醇 | C. | 二溴乙烷 | D. | 1,2,4-三甲苯 |
17.0.1mol/L Na2S溶液中,微粒间关系正确的是( )
| A. | [Na+]+[H+]=[OH-]+[HS-]+[S2-] | B. | [Na+]>[S2-]>[HS-]>[OH-] | ||
| C. | [Na+]=2[S2-]+2[HS-]+2[H2S] | D. | [Na+]>[HS-]>[S2-]>[OH-] |
7.不属于酸性氧化物的是( )
| A. | SO3 | B. | NO2 | C. | CO2 | D. | SO2 |
14.下列各组物质的熔点均与所含化学键的键能有关的是( )
| A. | CaCl2、SiO2 | B. | NaCl、HCl | C. | CaO、CO2 | D. | Cl2、I2 |
11.一种从植物中提取的天然化合物,可用于制作“香水”,其结构为: ,有关该化合物的下列说法错误的是( )
,有关该化合物的下列说法错误的是( )
 ,有关该化合物的下列说法错误的是( )
,有关该化合物的下列说法错误的是( )| A. | 分子式为C12H18O2 | |
| B. | 分子中至少有6个碳原子共平面 | |
| C. | 该化合物能使酸性高锰酸钾褪色 | |
| D. | 一定条件下,1mol该化合物最多可与3mol H2加成 |
11. 肼(N2H4)暴露在空气中容易爆炸,但利用其作燃料电池是一种理想的电池,具有容量大、能量转化率高、产物无污染灯特点,其工作原理如图所示,下列叙述正确的是( )
肼(N2H4)暴露在空气中容易爆炸,但利用其作燃料电池是一种理想的电池,具有容量大、能量转化率高、产物无污染灯特点,其工作原理如图所示,下列叙述正确的是( )
 肼(N2H4)暴露在空气中容易爆炸,但利用其作燃料电池是一种理想的电池,具有容量大、能量转化率高、产物无污染灯特点,其工作原理如图所示,下列叙述正确的是( )
肼(N2H4)暴露在空气中容易爆炸,但利用其作燃料电池是一种理想的电池,具有容量大、能量转化率高、产物无污染灯特点,其工作原理如图所示,下列叙述正确的是( )| A. | 电池工作时,正极附近的pH降低 | |
| B. | 当消耗1molO2时,有2molNa+由甲槽向乙槽迁移 | |
| C. | 负极反应为4OH-+N2H4-4e-=N2↑+4H2O | |
| D. | 若去掉离子交换膜电池也能正常工作 |
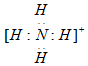 .写出实验室检验溶液中该离子的简单实验方案:取适量待测液于试管中,加入适量NaOH溶液后加热,若产生无色有刺激性气味的气体,且能使试管口湿润的红色石蕊试纸变蓝,则证明溶液中含有铵根离子.
.写出实验室检验溶液中该离子的简单实验方案:取适量待测液于试管中,加入适量NaOH溶液后加热,若产生无色有刺激性气味的气体,且能使试管口湿润的红色石蕊试纸变蓝,则证明溶液中含有铵根离子.