题目内容
5.铝及其化合物在日常生活、工业上有广泛的应用.(1)铝原子核外有13种不同运动状态的电子,有5种能量不同的电子.
(2)氮化铝具有强度高,耐磨,抗腐蚀,熔点可达2200℃.推测氮化铝是原子晶体,试比较组成该物质的两微粒半径大小Al>N.
(3)可用铝和氧化钡反应可制备金属钡:2Al+4BaO$\stackrel{高温}{→}$3Ba↑+BaO•Al2O3的主要原因是b (选填编号).
a.Al活泼性大于Ba b.Ba沸点比Al的低 c.BaO•Al2O3比Al2O3稳定
(4)氢氧化铝在水中发生酸式电离的电离方程式为:Al(OH)3?H++AlO2-+H2O,滴入少量盐酸,上述体系中Al3+浓度增大(填“增加”、“减少”或“不变”).
(5)工业上用氢氧化铝、氢氟酸和碳酸钠制取冰晶石(Na3AlF6).其反应物中有两种元素在周期表中位置相邻,可比较它们金属性或非金属性强弱的是a c (选填编号).
a.气态氢化物的稳定性 b.最高价氧化物对应水化物的酸(碱)性
c.单质与氢气反应的难易 d.单质与同浓度酸发生反应的快慢
(6)冰晶石可做电解氧化铝的助熔剂,此反应中若有0.6mol电子转移,则在阴极可得金属铝的质量为5.4克.工业上不用电解氯化铝而是用电解氧化铝的方法获得铝单质的原因因为氯化铝为共价化合物,属于分子晶体,晶体中不存在离子,熔融时不能导电,故不能被电解;而氧化铝为离子化合物,熔融状态可以导电.
分析 (1)铝是13号元素,核外电子有13个,每一个电子的运动状态都不同,核外电子排布式为1s22s22p63s23p1 ;有1s、2s、2p、3s、3p能级;
(2)原子晶体,硬度大、熔点高,粒子的电子层越多,粒子的半径越大;
(3)常温下Al的金属性比Ba的金属性弱,该反应是利用Ba的沸点比Al的低;
(4)根据Al(OH)3的酸式电离;根据Al(OH)3的碱式电离平衡以及外界条件对电离平衡的影响;
(5)根据反应物中的元素可知,氧、氟元素位置相邻,则利用非金属性强弱的判断方法来解答;
(6)电解池阳极发生氧化反应,阴极发生还原反应,而铝离子发生还原反应,应在阴极析出;根据电子转移守恒计算Al的物质的量,进而计算Al的质量;氯化铝为共价化合物,晶体中不存在离子,熔融时不能导电.
解答 解:(1)铝是13号元素,核外电子有13个,每一个电子的运动状态都不同,核外电子排布式为1s22s22p63s23p1 ,有5个能级,5种能量不同的电子,
故答案为:13;5;
(2)原子晶体硬度大,熔沸点高,根据氮化硅的物理性质:它的硬度大、熔点高、化学性质稳定,可知属于原子晶体,Al元素原子核外电子数为13,有3个电子层,N元素原子核外电子数为7,有2个电子层,电子层越多半径越大,所以微粒半径大小Al>N,
故答案为:原子;Al>N;
(3)利用元素Ba、Al在元素周期表的位置可知金属活泼性:Al<Ba;但Al在高温下可将氧化钡中钡置换出来,原因是Ba的沸点低于铝,高温时Ba转化为气体脱离反应体系,使反应正向进行,
故答案为:b;
(4)Al(OH)3的酸式电离:Al(OH)3?H++AlO2-+H2O,同时还存在碱式电离:Al(OH)3?Al3++3OH-,加入盐酸,与OH-反应,碱式电离平衡正向移动,Al3+浓度增大,
故答案为:Al(OH)3?H++AlO2-+H2O;增大;
(5)该反应中的物质含有的元素有Al、O、H、F、Na、C,只有O、F元素相邻,因F的非金属性最强,则没有正价,也就没有最高价氧化物对应水化物,它们也不与酸反应,但可以利用气态氢化物的稳定性和单质与氢气反应的难易来判断O、F非金属性的强弱,
故答案为:ac;
(6)电解池阳极发生氧化反应,阴极发生还原反应,而铝离子发生还原反应,应在阴极析出;根据电子转移守恒,析出Al的物质的量为$\frac{0.6mol}{3}$=0.2mol,故析出Al的质量为0.2mol×27g/mol=5.4g,因为氯化铝为共价化合物,属于分子晶体,晶体中不存在离子,熔融时不能导电,故不能被电解;而氧化铝为离子化合物,熔融状态可以导电,
故答案为:阴;5.4;因为氯化铝为共价化合物,属于分子晶体,晶体中不存在离子,熔融时不能导电,故不能被电解;而氧化铝为离子化合物,熔融状态可以导电.
点评 本题考查Al、N、F及其化合物的结构性质等,侧重于原子核外电子排布、同主族、同周期元素性质的递变规律的考查,注意氯化铝为共价化合物,为易错点,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 含有原子个数为0.3NA | B. | 分子个数约为6.02×1022 | ||
| C. | 物质的量是0.2mol | D. | 与质量相等的O2所含原子数相等 |
| A. | 使用铁触媒,加快合成氨反应速率 | |
| B. | 乙酸乙酯在碱性条件下水解比在酸性条件下水解更有利 | |
| C. | 打开汽水瓶盖,即有大量气泡逸出 | |
| D. | 配置FeCl3溶液时,加入少量盐酸 |
| A. | NH4+ | B. | HSO3- | C. | AlO2- | D. | Fe3+ |
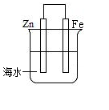
| A. | 此装置属于原电池 | |
| B. | 此装置中电子从铁经导线流向锌 | |
| C. | 此装置中的铁极上发生还原反应 | |
| D. | 该电化学防护法称为“牺牲阳极阴极保护法” |
| A. | 2-乙基戊烷 | B. | 1-甲基丙醇 | C. | 二溴乙烷 | D. | 1,2,4-三甲苯 |
| A. | [Na+]+[H+]=[OH-]+[HS-]+[S2-] | B. | [Na+]>[S2-]>[HS-]>[OH-] | ||
| C. | [Na+]=2[S2-]+2[HS-]+2[H2S] | D. | [Na+]>[HS-]>[S2-]>[OH-] |
| A. | CaCl2、SiO2 | B. | NaCl、HCl | C. | CaO、CO2 | D. | Cl2、I2 |
| A. | 一定向正反应方向移动 | |
| B. | 一定向逆反应方向移动 | |
| C. | 在平衡移动时正反应速率先减小后增大 | |
| D. | 在平衡移动时逆反应速率先增大后减小 |