题目内容
4.元素X、Y、Z位于相同短周期,它们的最高及最低化合价如表所示,下列判断错误的是( )| 元素 | X | Y | Z |
| 最高、最低化合价 | +7 -1 | +6 -2 | +5 -3 |
| A. | 原子序数:X>Y>Z | B. | 原子半径:X>Y>Z | ||
| C. | 稳定性:HX>H2Y>ZH3 | D. | 酸性由强到弱:HXO4>H2YO4>H3ZO4 |
分析 X、Y、Z位于相同短周期,由化合价可知,X为Cl,则Y为S,Z为P,
A.同周期从左向右原子序数增大;
B.同周期从左向右原子半径减小;
C.同周期从左向右非金属性增强,对应氢化物的稳定性增强;
D.非金属性越强,对应最高价含氧酸的酸性越强.
解答 解:X、Y、Z位于相同短周期,由化合价可知,X为Cl,则Y为S,Z为P,
A.同周期从左向右原子序数增大,则原子序数:X>Y>Z,故A正确;
B.同周期从左向右原子半径减小,则原子半径:Z>Y>X,故B错误;
C.同周期从左向右非金属性增强,对应氢化物的稳定性增强,则稳定性:HX>H2Y>ZH3,故C正确;
D.非金属性越强,对应最高价含氧酸的酸性越强,则酸性由强到弱:HXO4>H2YO4>H3ZO4,故D正确;
故选B.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的性质、元素周期律为解答本题的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案
相关题目
11.已知某400mL待测液中可能含有Cl-、SO42-、CO32-、Fe3+和Na+五种离子中的若干种.取该溶液100mL,加入足量NaOH溶液产生红褐色沉淀,过滤、洗涤、灼烧得到1.6g固体,向上述溶液中加足量BaCl2溶液,得到4.66g沉淀,加入盐酸,沉淀不溶解.下列判断不正确的是( )
| A. | 待测液中一定存在SO42-、Fe3+、Cl-,可能存在Na+ | |
| B. | 待测液中:c(Cl-)≥0.2mol•L-1 | |
| C. | 另取100mL待测液加入足量Ba(OH)2溶液,可得6.8g沉淀 | |
| D. | 另取100mL待测液加入足量AgNO3溶液,可得2.87g沉淀 |
15.O3不仅有强氧化性,而且在大气中还具有吸收紫外线的功能,下列关于4.8g O3的说法不正确的是(NA表示阿伏加德罗常数)( )
| A. | 含有原子个数为0.3NA | B. | 分子个数约为6.02×1022 | ||
| C. | 物质的量是0.2mol | D. | 与质量相等的O2所含原子数相等 |
16.不能用勒夏特列原理解释的是( )
| A. | 使用铁触媒,加快合成氨反应速率 | |
| B. | 乙酸乙酯在碱性条件下水解比在酸性条件下水解更有利 | |
| C. | 打开汽水瓶盖,即有大量气泡逸出 | |
| D. | 配置FeCl3溶液时,加入少量盐酸 |
13.常温下,由水电离的c(H+)=1×10-13mol/L的溶液中一定不可能大量存在的离子是( )
| A. | NH4+ | B. | HSO3- | C. | AlO2- | D. | Fe3+ |
14.下列各组物质的熔点均与所含化学键的键能有关的是( )
| A. | CaCl2、SiO2 | B. | NaCl、HCl | C. | CaO、CO2 | D. | Cl2、I2 |
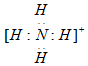 .写出实验室检验溶液中该离子的简单实验方案:取适量待测液于试管中,加入适量NaOH溶液后加热,若产生无色有刺激性气味的气体,且能使试管口湿润的红色石蕊试纸变蓝,则证明溶液中含有铵根离子.
.写出实验室检验溶液中该离子的简单实验方案:取适量待测液于试管中,加入适量NaOH溶液后加热,若产生无色有刺激性气味的气体,且能使试管口湿润的红色石蕊试纸变蓝,则证明溶液中含有铵根离子.



 镁、钡是位于同一主族的活泼的金属元素.
镁、钡是位于同一主族的活泼的金属元素. .
.