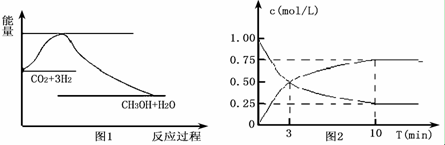
题目内容
11.元素周期表中碲元素的数据见下图,下列说法中正确的是( )
| A. | Te原子的相对原子质量是127.5 | |
| B. | Te元素可能会有多种同位素 | |
| C. | Te原子5p亚层有2对成对电子 | |
| D. | Te原子最外层有6个运动状态相同的电子 |
分析 由题给数据可知Te元素的相对原子质量为127.5,由价层电子排布可知位于周期表第五周期ⅥA族,在核外电子排布中,电子的运动状态各不相同,以此解答该题.
解答 解:A.元素可有多种核素,不同原子的相对原子质量不同,127.5为Te元素的相对原子质量,故A错误;
B.同位素原子的质子数相同,属于同一种元素,同种元素可对应多种原子,故B正确;
C.Te原子5p亚层有1对成对电子,故C错误;
D.Te原子最外层有6个低、案子、,运动状态都不相同,故D错误.
故选B.
点评 本题考查元素周期表的应用,侧重考查基本概念、化学用语,明确表中每一数据、字母的含义是解本题关键,熟练掌握元素周期表、原子结构,题目难度不大.

练习册系列答案
相关题目
1.下列表示方法或说法正确的是( )
| A. | Na+的离子结构示意图: | |
| B. | 乙烯的结构简式为:CH2CH2 | |
| C. | 苯分子的结构中没有碳碳单键和碳碳双键,苯分子中的碳碳键是介于它们之间独特的键 | |
| D. | 实验室中用二氧化锰与稀盐酸反应制取Cl2 |
19.某元素R的最高价氧化物的化学式为R2O5,已知其气态氢化物含氢8.8%,则元素R的相对原子质量为( )
| A. | 14 | B. | 28 | C. | 31 | D. | 35.5 |
6.下列关于物质的分离、提纯实验中的一些操作或做法,正确的是( )
| A. | 在组装蒸馏装置时,温度计的水银球应伸入液面下 | |
| B. | 用苯萃取溴水时有机层应从下口放出 | |
| C. | 在苯甲酸重结晶实验中,粗苯甲酸加热溶解后还要加少量蒸馏水 | |
| D. | 在苯甲酸重结晶实验中,待粗苯甲酸完全溶解后,要冷却到常温才过滤 |
3.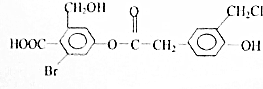 有机物N的结构如图所示,1mol有机物N在一定条件下分别与足量NaOH(溶液),NaHCO3(溶液),H2反应理论上消耗这3种物质的物质的量之比为( )
有机物N的结构如图所示,1mol有机物N在一定条件下分别与足量NaOH(溶液),NaHCO3(溶液),H2反应理论上消耗这3种物质的物质的量之比为( )
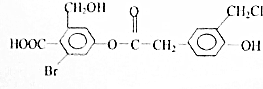 有机物N的结构如图所示,1mol有机物N在一定条件下分别与足量NaOH(溶液),NaHCO3(溶液),H2反应理论上消耗这3种物质的物质的量之比为( )
有机物N的结构如图所示,1mol有机物N在一定条件下分别与足量NaOH(溶液),NaHCO3(溶液),H2反应理论上消耗这3种物质的物质的量之比为( )| A. | 8:1:7 | B. | 5:1:6 | C. | 5:2:6 | D. | 7:1:6 |
3.下列试剂可以贮存在普通玻璃试剂瓶中的是( )
| A. | 氢氟酸 | B. | 浓盐酸 | C. | 溴水 | D. | 碘化银固体 |